题目内容
2.某有机物A用质谱仪测定如图①,核磁共振氢谱示意图如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为( )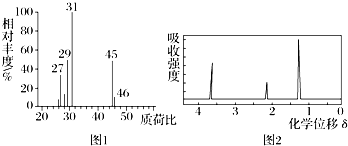
| A. | CH3CH2OH | B. | CH3CHO | C. | HCOOH | D. | CH3CH2CH2COOH |
分析 质谱仪中质荷比最大的数即为其相对分子质量,核磁共振氢谱图中含有几个峰,表示该有机物中含有几个位置不同的氢原子,据此判断有机物A的结构.
解答 解:由图①可知此有机物的最大质荷比为46,故其相对分子质量为46,由图②可知:有机物A中存在三种化学环境不同的H,且吸收强度为3:2:1,故A为乙醇,故选A.
点评 本题考查了有机物的分子式、结构简式的确定,题目难度中等,注意掌握确定有机物分子式、结构简式的方法,明确质谱仪中的质荷比、核磁共振氢谱中峰的含义为解答本题的关键.

练习册系列答案
相关题目
13.下列排列顺序正确的是( )
| A. | 原子半径:O>N>C | B. | 热稳定性:H2O>HF>H2S | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 酸性:H3PO4>H2SO4>HClO4 |
10.根据下列事实所作出的结论正确的是( )
| 选项 | 事实 | 结论 |
| A | 完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| B | 灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C | 在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 说明此盐一定不含碘 |
| D | 甲乙两种有机物,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
17.已知2SO2(g)+O2(g)?2SO3(g);△H=-196.64kJ•mol-1,下列说法正确的是( )
| A. | 该反应是吸热反应 | |
| B. | SO2燃烧热为196.64kJ•mol-1 | |
| C. | 在容器中充入1mol SO2和0.5mol O2充分反应,热变化为98.32kJ | |
| D. | 当有NA个电子发生转移时,热变化为49.16kJ |
7.哈伯因发明了由氮气合成氨气的方法而获得诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生.下列有关说法正确的是( )
| A. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| C. | 达到化学平衡时,N2将完全转化为NH3 | |
| D. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
14.如图各装置不能构成原电池的是( )
| A. |  | B. | 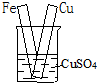 | C. | 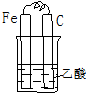 | D. | 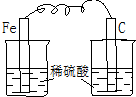 |
11.下列各组有机物,不论按何种比例混合,只要总质量一定,完全燃烧生成水的总质量就相同的是( )
| A. | 甲烷、丙烷 | B. | 甲苯、甘油 | C. | 甲酸、乙酸 | D. | 乙醇、乙二醇 |
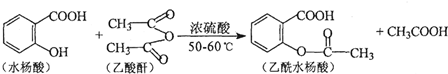
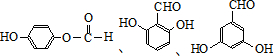 (任意一种).
(任意一种). (不写条件).
(不写条件). .
.