题目内容
【题目】高锰酸钾是实验室常用的氧化剂。某实验小组制备高锰酸钾,具体流程如图:

实验一:锰酸钾的制备。称取3.0 g KClO3固体和 7. 0 g KOH固体混合,于铁坩埚中小火加热,待混合物熔融后用铁棒不断搅拌,再加入4.0g MnO2 继续加热。
(1)熔融时加人 MnO2 后坩埚中反应的化学方程式为 _____________。
(2)用铁棒而不用玻璃棒搅拌的原因是______________ 。
实验二:锰酸钾的歧化。待铁坩埚冷凉后放人烧杯中,加水共煮浸取,取出坩埚,开启启普发生器,趁热向溶液中通入CO2,直到溶液绿色全部变为紫色为止,静置沉淀,用砂芯漏斗进行抽滤,留滤液。歧化反应实验装置如图所示:

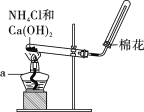
(3)向启普发生器中加入块状固体的位置_______ (选填字母“a”“b”或“ c”)。该仪器的优点是方便控制反应的发生与停止,其原理是_____________。
(4)烧杯中锰酸钾歧化反应的化学方程式为___________________。
(5)锰酸钾歧化时不能用盐酸代替 CO2,原因是_______________ 。
实验三:锰酸钾的浓缩结晶。将滤液转移至蒸发皿中,蒸发浓缩,自然冷却结晶,抽滤至干。将晶体转移至已知质量的表面皿上,放入烘箱中 80℃ 干燥半小时左右,冷却,称量,产品质量为 3.16 g。
(6)蒸发浓缩滤液至___________停止加热。
(7)该实验小组制备高锰酸钾的产率是____________。
【答案】KClO3+3MnO2+6KOH![]() 3K2MnO4+KCl+3H2O 玻璃棒中的SiO2在熔融状态下与KOH反应 b 打开止水夹,块状固体与液体接触发生反应,关闭止水夹,启普发生器内压强增大,液体被压入长颈漏斗,块状固体和液体脱离接触,反应停止。 3K2MnO4 +2CO2=MnO2+2KMnO4+2K2CO3 锰酸钾可以将盐酸氧化放出氯气造成污染,同时也降低高锰酸钾的产率 溶液表面出现晶膜时 65.25%
3K2MnO4+KCl+3H2O 玻璃棒中的SiO2在熔融状态下与KOH反应 b 打开止水夹,块状固体与液体接触发生反应,关闭止水夹,启普发生器内压强增大,液体被压入长颈漏斗,块状固体和液体脱离接触,反应停止。 3K2MnO4 +2CO2=MnO2+2KMnO4+2K2CO3 锰酸钾可以将盐酸氧化放出氯气造成污染,同时也降低高锰酸钾的产率 溶液表面出现晶膜时 65.25%
【解析】
(1)根据氧化还原反应分析化学方程式;
(2)玻璃棒的成分为SiO2;
(3)根据启普发生器原理分析;
(4)根据氧化还原反应分析化学方程式;
(5)锰酸钾具有强氧化性,与HCl反应;
(6)根据蒸发结晶的操作作答;
(7)根据质量守恒关系式计算产率。
(1)根据信息,反应方程式为:MnO2+KClO3+KOH→K2MnO4+KCl,MnO2→K2MnO4化合价↑2,KClO3→KCl化合价↓6,最小公倍数为6,因此MnO2、K2MnO4的系数为3,根据钾元素守恒,KOH的系数为6,根据原子守恒,配平其他,则KClO3+3MnO2+6KOH![]() 3K2MnO4+KCl+3H2O,故答案为:KClO3+3MnO2+6KOH
3K2MnO4+KCl+3H2O,故答案为:KClO3+3MnO2+6KOH![]() 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;
(2)玻璃的成分中含SiO2,因为SiO2属于酸性氧化物,可以和KOH反应,因此不能用玻璃仪器,而用铁坩埚和铁制搅拌棒,故答案为:玻璃棒中的SiO2在熔融状态下与KOH反应;
(3)固体放在启普发生器的中间层,从b处加入块状固体;打开止水夹,块状固体与液体接触发生反应,关闭止水夹,启普发生器内压强增大,液体被压入长颈漏斗,块状固体和液体脱离接触,反应停止,故答案为:b;打开止水夹,块状固体与液体接触发生反应,关闭止水夹,启普发生器内压强增大,液体被压入长颈漏斗,块状固体和液体脱离接触,反应停止;
(4) MnO42-→MnO4-+MnO2,MnO42-→MnO4-化合价↑1,MnO42-→MnO2化合价↓2,最小公倍数为2,即MnO4-的系数为2,则MnO42-的系数为3,根据反应前后原子守恒和所带电荷守恒,CO2转化成了CO32-,因此化学反应方程式为:3K2MnO4+2CO2=MnO2+2KMnO4+2K2CO3,故答案为:3K2MnO4+2CO2=MnO2+2KMnO4+2K2CO3;
(5)锰酸钾具有强氧化性,与HCl反应生成氯气,造成污染,同时也降低高锰酸钾的产率,故答案为:锰酸钾可以将盐酸氧化放出氯气造成污染,同时也降低高锰酸钾的产率;
(6)蒸发浓缩滤液至溶液表面出现晶膜时停止加热,故答案为:溶液表面出现晶膜时;
(7)由(1)有KClO3+3MnO2+6KOH![]() 3K2MnO4+KCl+3H2O,加入4.0g MnO2消耗的KClO3的质量为1.88g,消耗的KOH的质量为5.15g,可知MnO2完全反应,再结合3K2MnO4 +2CO2=MnO2+2KMnO4+2K2CO3,则有关系式
3K2MnO4+KCl+3H2O,加入4.0g MnO2消耗的KClO3的质量为1.88g,消耗的KOH的质量为5.15g,可知MnO2完全反应,再结合3K2MnO4 +2CO2=MnO2+2KMnO4+2K2CO3,则有关系式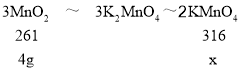 ,则理论上生成的高锰酸钾质量x=
,则理论上生成的高锰酸钾质量x=![]() ,高锰酸钾的产率是
,高锰酸钾的产率是![]() ,故答案为:65.25%。
,故答案为:65.25%。

【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定作氧化剂 |
B | NaHCO3溶液与NaAlO2溶液混合,立即产生白色沉淀 | 结合H+的能力:AlO2->CO32- |
C | 向盛有Cu2O的试管中加入足量稀硫酸,溶液变为蓝色,试管底有红色沉淀 | 氧化性:H+>Cu2+ |
D | 向2支盛有2mL0.1mol/LNaOH溶液的试管中分别滴入2滴0.1mol/LAlCl3、MgCl2溶液,振荡,前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A.AB.BC.CD.D
【题目】下列实验装置不能达到实验目的的是
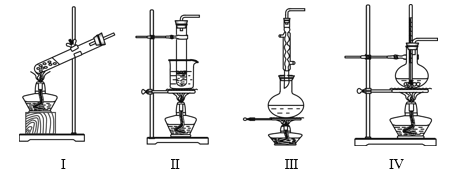
选项 | 实验目的 | 反应试剂及所需物质 | 选择装置 |
A | 制乙酸乙酯 | 无水乙醇、冰醋酸、浓硫酸、碎瓷片 | Ⅰ |
B | 进行银镜实验 | 银氨溶液、乙醛 | Ⅱ |
C | 制葡萄糖酸 | 葡萄糖、3%溴水 | Ⅲ |
D | 制乙烯 | 无水乙醇、浓硫酸、碎瓷片 | Ⅳ |
[注:葡萄糖与3%溴水在55 ℃左右反应]
A. AB. BC. CD. D