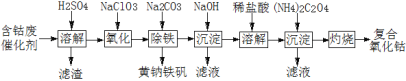
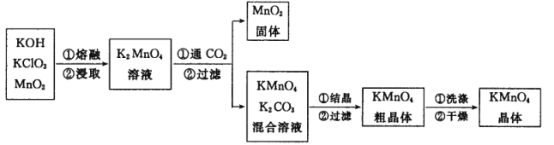
题目内容
【题目】根据下面的反应路线及所给信息填空:
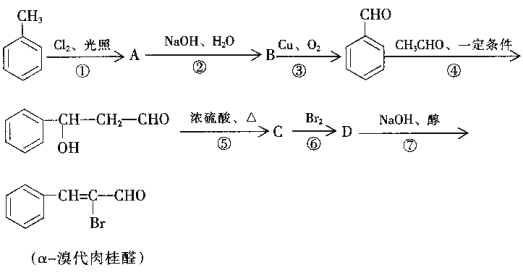
(1)反应①的类型是__________________,反应⑥的类型是____________________。
(2)C的结构简式是___________________,D的结构简式是___________。
(3)写出反应②的化学方程式:_________________________________________。
(4)反应⑦中,除生成α-溴代肉桂醛的同时,是否还有可能生成其他有机物?若有,请写出其结构简式:_______________________________。(只写一种)
【答案】取代反应 加成反应 ![]()
![]()
![]() +NaOH
+NaOH![]()
![]() +NaCl
+NaCl ![]()
【解析】
甲苯在光照条件下与氯气发生取代反应生成的A为![]() ,A水解生成的B为
,A水解生成的B为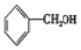 ,反应⑤在浓硫酸作用下发生消去反应,生成的C为
,反应⑤在浓硫酸作用下发生消去反应,生成的C为![]() ,C与溴发生加成生成的D为
,C与溴发生加成生成的D为![]() ,D发生消去反应生成α—溴代肉桂醛,结合有机物的官能团的性质解答该题.
,D发生消去反应生成α—溴代肉桂醛,结合有机物的官能团的性质解答该题.
(1)反应①为甲苯在光照条件下与氯气发生取代反应,反应⑥为加成反应;
(2)由以上分析可知C为![]() ,D为
,D为![]() ;
;
(3)反应②氯代烃的水解反应,反应的方程式为:![]() +NaOH
+NaOH![]()
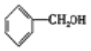 +NaCl;
+NaCl;
(4)![]() 在NaOH的醇溶液中发生消去反应,脱去1分子HBr或2分子HBr,可生成α-溴代肉桂醛或
在NaOH的醇溶液中发生消去反应,脱去1分子HBr或2分子HBr,可生成α-溴代肉桂醛或![]() ;
;

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
A | 向氯化亚铁溶液中通入氯气 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Fe2+具有还原性 |
C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe2+具有氧化性 |
A.AB.BC.CD.D
【答案】A
【解析】
A.向氯化亚铁溶液中通入氯气,浅绿色溶液变成棕黄色溶液,说明Fe2+具有还原性,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故A正确;
B.在氯化亚铁溶液中加入锌片,浅绿色溶液变成无色溶液,说明Fe2+具有氧化性,发生的离子反应为Fe2++Zn=Fe+Zn2+,故B错误;
C.离子方程式电荷不守恒,正确的离子方程式为2Fe3++Fe=3Fe2+,故C错误;
D.在氯化铁溶液中加入铜粉,溶液颜色应由棕黄色变成蓝色,故D错误;
故答案为A。
【题型】单选题
【结束】
18
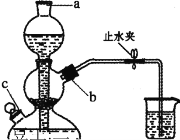
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )
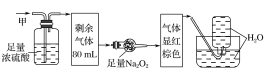
A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【题目】氢能是一种公认的高热值清洁能源,目前世界各国正致力于将高污染高排放的碳能源过渡成清洁高效低排放的氢能源。氢能开发包括以下三个环节:
一、氢燃料的制备
(1)我国氢气的主要来源是焦炉气制氢,所制得的氢气含有较多的CO和H2S,中温干法脱硫是用氧化铁将硫元素转化为硫化铁。干法脱硫的反应方程式为________。
(2)我国科研人员用木屑水蒸汽气化制取氢燃料,在一定条件下,反应器中存在如下反应:
i.CO2 (g) +C(s)=2CO (g) △H1
ii.C(s) + H2O(g)=CO ( g) + H2 (g) △H2
iii.C(s) + 2H2 (g)=CH4( g) △H3
iv.CO(g) + H2O(g)=CO2 ( g) + H2 (g) △H4
v. CH4(g)+ 2 H2O(g)= CO2 ( g) + 4H2 (g) △H5
①△H5=_________________ 。
②研究中 CaO 的添加量按照CaO 中所含的Ca 和松木屑所含碳的物质的量比确定,在750℃,控制水蒸气流量为 0.lg/(ming)下,探究催化剂加入量对产气组分和气化性能的影响,结果如表所示:
n(Ca)/n(C) | 气体体积分数 | 碳转化率/% | |||
H2 | CO | CO2 | CH4 | ||
0 | 45.58 | 22.70 | 22.37 | 7.54 | 61.22 |
0.5 | 52.95 | 21.74 | 19.11 | 5.14 | 56.59 |
1.0 | 58.62 | 22.37 | 12.60 | 5.31 | 61.42 |
由表中数据,n(Ca) / n(C) =___时最为合理。 n(Ca) / n(C) 由0到0.5时,H2的体积分数显著增加的原因_____。体系的气化温度不仅对木屑的热解气化反应有影响 ,而且对 CaO 吸收 CO2 的能力以及 CaCO3的分解反应也有很大影响。实验过程中,控制 n(Ca) / n(C) 为 1.0,水蒸气流量为0.1 g/(min g), 将气化反应温度从700℃升到850℃,气化温度对产氢率、产气率的影响如表:
温度/℃ | 气体体积分数 | 碳转化率/% | ||
H2 | CO | CO2 | ||
700 | 51.78 | 20.75 | 19.89 | 54.37 |
750 | 58.62 | 22.37 | 12.60 | 61.42 |
800 | 55.63 | 26.05 | 12.71 | 73.43 |
850 | 54.16 | 26.94 | 13.82 | 83.34 |
③从产氢率的角度考虑,最佳操作温度是________________。
④随着反应的进行,发现 CaO 的吸收能力逐渐降低,原因是___________。
二、氢燃料的存储
(3)将氢气储存于液体燃料中,可以解决氢气的安全高效存储和运输问题。由于甲醇具有单位体积储氢量高、活化温度低等优点,是理想的液体储氢平台分子。我国学者构建一种双功能结构的催化剂,反应过程中,在催化剂的表面同时活化水和甲醇。如图是甲醇脱氢转化的反应历程( TS 表示过渡态)。
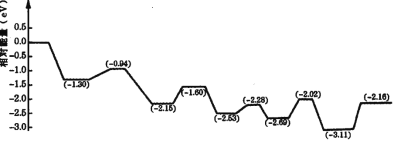
根据图像判断甲醇脱氢反应中断裂的化学键是______,该反应的△H___0( 填“大于”、“等于”或“小于”)
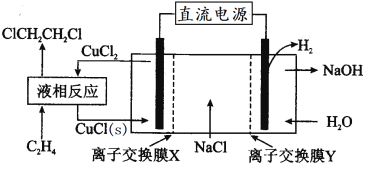
三、氢燃料的应用。一种氢能电池的原理如图:
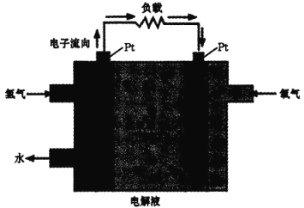
(4)正极的电极反应式为________。在 Pt 电极表面镜一层细小的铅粉,原因是______。