题目内容
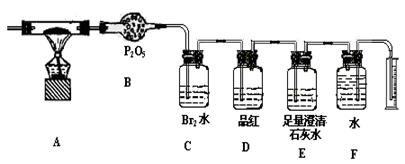
(20分)某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质______、_______。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B ,
D 。
(3)装置C的作用是 。
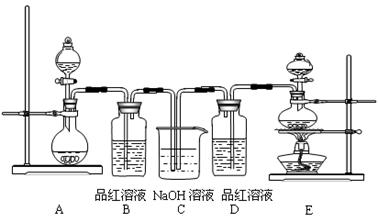
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
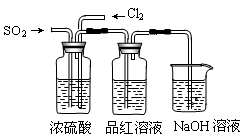
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是
,
反应的离子方程式是 ;
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
。

(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质______、_______。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B ,
D 。
(3)装置C的作用是 。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是
,
反应的离子方程式是 ;
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
。
(20分)(1)酸性(2分)、还原性(2分);(2)B溶液恢复红色(2分),D溶液仍无色(2分)
(3)吸收多余的SO2和Cl2,防止污染环境(3分)
(4)①SO2和Cl2按物质的量之比1︰1恰好完全反应,生成无漂白性的H2SO4和HCl;(3分)
SO2 + Cl2 + 2H2O =SO42-+ 2Cl—+ 4H+ (3分)②控制SO2和Cl2进气的物质的量,使之不相等(3分)
(3)吸收多余的SO2和Cl2,防止污染环境(3分)
(4)①SO2和Cl2按物质的量之比1︰1恰好完全反应,生成无漂白性的H2SO4和HCl;(3分)
SO2 + Cl2 + 2H2O =SO42-+ 2Cl—+ 4H+ (3分)②控制SO2和Cl2进气的物质的量,使之不相等(3分)
试题分析:(1)在二氧化锰和浓盐酸反应制取氯气的反应中,盐酸被氧化,起还原剂的作用。另外含有氯化锰生成,所以还起到酸性的作用。
(2)氯气溶于水生成的次氯酸和SO2均具有漂泊性,能使品红溶液褪色,但前者是不可逆的,后者是可逆的,在加热的条件下又能恢复到红色。即B溶液恢复红色,D溶液仍无色。
(3)氯气和SO2都是大气污染物,所以C中氢氧化钠溶液的作用是吸收多余的SO2和Cl2,防止污染环境。
(4)①由于氯气具有氧化性,能氧化SO2,即SO2和Cl2按物质的量之比1︰1恰好完全反应,生成无漂白性的H2SO4和HCl,所以不褪色。反应的离子方程式是SO2 + Cl2 + 2H2O =SO42-+ 2Cl—+ 4H+。
②要做到让品红溶液变得越来越浅,则氯气或SO2中必须有一种是过量的,因此正确的做法是控制SO2和Cl2进气的物质的量,使之不相等。2的漂白原理以及尾气处理
点评:该题是中等难度的试题,试题注重基础,主要是考查学生对氯气和SO2漂白原理的了解掌握情况。该题主要是通过实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。

练习册系列答案
相关题目