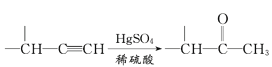
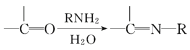
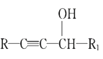题目内容
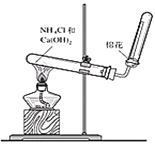
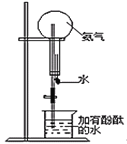
【题目】为了验证木炭可被浓H2SO4氧化成CO2,选用如图所示仪器(内含物质)组装成实验装置(资料:SO2能与酸性KMnO4反应:2KMnO4 + 5SO2 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4 )。
甲. 乙.
乙. 丙.
丙.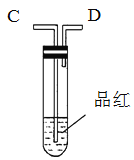 丁.
丁.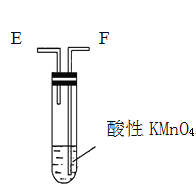
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):A接________,________接________,________接________;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2。乙中_______,丙中______。
【答案】F E C D B 乙中出现白色沉淀 丙中品红未褪色
【解析】
(1)根据实验室浓H2SO4氧化木炭的反应原理、条件,固液加热下反应,进行选择发生和验证产物装置;
(2)根据二氧化碳和二氧化硫的性质进行解答。
(1)根据实验室浓H2SO4氧化木炭的反应原理、条件,固液加热下反应,进行选择发生装置,高锰酸钾可氧化二氧化硫,用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色确认SO2已除干净,验证木炭可被浓H2SO4氧化成CO2,可通过二氧化碳能使澄清的石灰水变浑浊确认,即装置的连接顺序为A接F;E接C;D接B;
(2)乙中为澄清的石灰水,澄清的石灰水和二氧化碳反应变浑浊,二氧化硫具有漂白性,二氧化硫能使品红褪色,丁装置用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】氮化镓(GaN)是一种重要的半导体材料。某工厂利用铝土矿(成分为Al2O3、Ga2O3、Fe2O3等)为原料制备GaN的流程如下图所示:
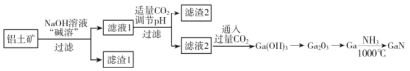
已知:镓与铝同主族,镓的熔点是29.8°C,沸点是2403°C;其氧化物和氢氧化物均为两性化合物;氢氧化物的电离常数如下:
两性氢氧化物 | Al( OH)3 | Ga( OH)3 |
酸式电离常数Ka | 2×10-11 | 1×10-7 |
碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
回答下列问题:
(1)为了提高 “碱溶”效率应采用的措施是__________(回答两种措施)。
(2)滤渣1的成分是_________。
(3)滤液2中通入过量CO2的理由是________(用离子方程式表示)。
(4)流程中利用镓与NH3在1000℃反应生成固体半导体材料 GaN,每生成l molGaN时放出15. 45 kJ热量,写出该反应的热化学方程式________。
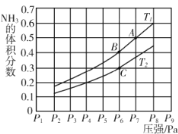
(5)在密闭容器中,充入一定量的Ga与NH3发生反应 ,测得反应平衡体系中NH3的体积分数与压强 P和温度T 的关系曲线如下图所示。图中A 点和C点化学平衡常数的大小关系: KA____KC (填“<”“=”或 “ > ”) , 判断的依据是________。
(6)已知铝土矿中Ga2O3的质量分数为 a%,某工厂使用 w 吨铝土矿经过一系列反应, 反应过程中镓元素的总利用率为 b%能制得________吨氮化镓