题目内容
【题目】向7.5mL0.03molL-1的H3PO4溶液中,逐滴加入相同浓度的NaOH溶液,溶液pH与NaOH溶液体积关系如图所示,已知Ka1>Ka2>Ka3,下列说法错误的是
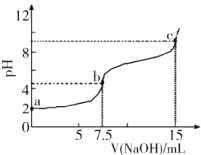
A.H3PO4第一级电离平衡常数Ka1的数量级为10-3
B.水的电离程度:b<c
C.b点溶液中离子浓度:c(Na+)>c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c点溶液中:2c(H3PO4)+c(![]() )+c(H+)=c(OH-)+c(
)+c(H+)=c(OH-)+c(![]() )
)
【答案】C
【解析】
A.据图可知未滴加NaOH溶液时,0.03mol/L的pH=2,此时主要以H3PO4![]()
![]() +H+为主,则该溶液中c(H+)= c(
+H+为主,则该溶液中c(H+)= c(![]() )=10-2mol/L,Ka1=
)=10-2mol/L,Ka1=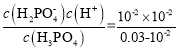 =5×10-3,故A正确;
=5×10-3,故A正确;
B.根据滴加的NaOH溶液的量可知,b点溶质为NaH2PO4,此时溶液显酸性,说明![]() 的电离程度大于水解程度,所以水的电离受到抑制,c点溶质为Na2HPO4,此时溶液显碱性,说明
的电离程度大于水解程度,所以水的电离受到抑制,c点溶质为Na2HPO4,此时溶液显碱性,说明![]() 的水解程度大于电离程度,水的电离受到促进,所以水的电离程度b<c,故B正确;
的水解程度大于电离程度,水的电离受到促进,所以水的电离程度b<c,故B正确;
C.b点溶质为NaH2PO4,溶液中存在电离平衡:![]()
![]()
![]() +H+,
+H+,![]()
![]()
![]() + H+,H2O
+ H+,H2O![]() OHˉ+ H+,所以c(H+)>c(
OHˉ+ H+,所以c(H+)>c(![]() ),故C错误;
),故C错误;
D.c点溶质为Na2HPO4,根据电荷守恒有c(H+)+ c(Na+)= c(OH-)+3c(![]() )+2c(
)+2c(![]() )+c(
)+c(![]() ),根据物料守恒有c(Na+)= 2c(
),根据物料守恒有c(Na+)= 2c(![]() )+2c(
)+2c(![]() )+2c(
)+2c(![]() )+2c(H3PO4),二式联立可得2c(H3PO4)+c(
)+2c(H3PO4),二式联立可得2c(H3PO4)+c(![]() )+c(H+)=c(OH-)+c(
)+c(H+)=c(OH-)+c(![]() ),故D正确;
),故D正确;
故答案为C。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
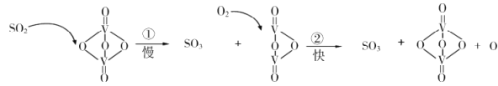
期末集结号系列答案【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
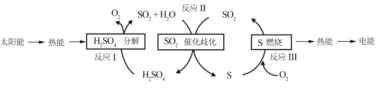
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
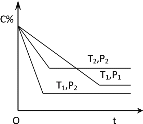
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
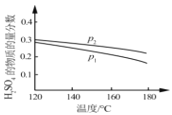
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。

【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D