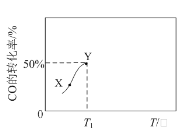
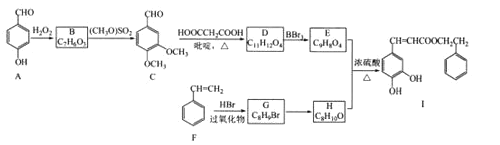
题目内容
【题目】下列说法不正确的是
A.0.1molL-1CH3COOH溶液加水稀释,CH3COO-数目增多,c(OH-)增大
B.室温下,NaHSO3溶液的pH<7,说明![]() 的电离程度大于其水解程度
的电离程度大于其水解程度
C.酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱。由该理论可知:NaHCO3、H2O、Al(OH)3均可称为酸碱两性物质
D.25℃时0.1molL-1的H2S水溶液中,加入一定量的NaOH溶液,当溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S)时,溶液的主要溶质为Na2S
【答案】D
【解析】
A.0.1molL-1CH3COOH溶液加水稀释,电离平衡正向移动,CH3COO-数目增多,c(H+)减小, c(OH-)增大,故A正确;
B.![]() 电离出H+、
电离出H+、![]() 水解出OH-,室温下,NaHSO3溶液的pH<7,说明
水解出OH-,室温下,NaHSO3溶液的pH<7,说明![]() 的电离程度大于其水解程度,故B正确;
的电离程度大于其水解程度,故B正确;
C.HCO3-能结合氢离子生成二氧化碳、HCO3-能电离出氢离子和碳酸根离子,H2O能电离出氢离子和氢氧根离子,H2O结合氢离子生成H3O+,Al(OH)3能结合氢离子生成铝离子、Al(OH)3电离出氢离子和AlO2-,酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱。由该理论可知:NaHCO3、H2O、Al(OH)3均可称为酸碱两性物质,故C正确;
D.25℃时0.1molL-1的H2S水溶液中,加入一定量的NaOH溶液,根据物料守恒,当溶液中存在c(Na+)=c(S2-)+c(HS-)+c(H2S)时,溶液的主要溶质为NaHS,故D错误;
答案选D。

 名校课堂系列答案
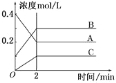
名校课堂系列答案【题目】反应2AB+D在四种不同条件下进行,B、D起始浓度为零,A的浓度(molL-1)随反应时间(min)的变化情况如下表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法正确的是
A.在实验1,反应在10至20分钟时间内物质A的平均速率为0.013mol/(Lmin)
B.在实验2,A的初始浓度c2>1.0molL-1
C.设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1
D.实验4中,该反应在30min后才达到平衡状态
【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
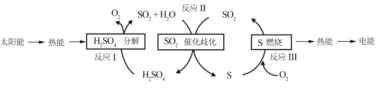
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
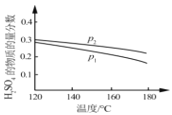
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。