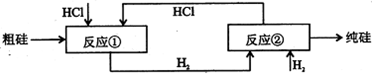
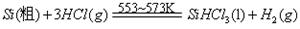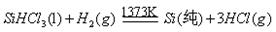题目内容

(1) 已知:450℃时NH3的浓度大于550℃时,则正反应是______ __热反应;
(2) 反应进程中:0~2s内N2的物质的量由2mol变为1mol,则υ(H2)=___________;
(3) 能说明该反应已经达到平衡状态的是_________ __;
A.c(N2)=c(H2)="c" (NH3) B.容器内压强保持不变
C.υ(N2)=3υ(H2) D.容器内的密度保持不变
(4) 可使该反应的反应速率增大,且平衡向正反应方向移动的措施是__________。
A.及时分离出NH3气体 B.适当升高温度
C. 增大压强 D.选择高效的催化剂
(1)放热(1分) (2)0.75mol/(L·s) (2分) (3)B (1分) (4)C(1分)
本题考查化学反应速率及化学平衡有关知识,关键在于明确化学反应速率的影响因素及化学平衡的判断。(1)450℃时NH3的浓度大于550℃时,说明温度升高,平衡向逆反应方向移动,则正反应是放热反应;(2)υ(H2)=3υ(N2)=3(2-1)/(2×2)= 0.75mol/(L·s);(3) A中浓度相等,但不一定达到平衡,只有浓度不在改变时,表示达到了平衡,该反应是体积不相等的反应,体积固定,故压强不变,表示该反应已达平衡;C项中未指明是正反应速率还是逆反应速率,故不能表示该反应已达平衡;体积固定,质量不变,密度不变,故不能表示该反应已达平衡;故选B。
(4)及时分离出NH3气体,减少生成物,减小逆反应速率,A不合题意;适当升高温度,平衡向逆反应方向移动,B不合题意;增大压强,反应速率增大,平衡向正反应方向移动,C合题意,正确;催化剂只改变反应速率,不影响平衡移动,D不合题意,故选C。
(4)及时分离出NH3气体,减少生成物,减小逆反应速率,A不合题意;适当升高温度,平衡向逆反应方向移动,B不合题意;增大压强,反应速率增大,平衡向正反应方向移动,C合题意,正确;催化剂只改变反应速率,不影响平衡移动,D不合题意,故选C。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目

 CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。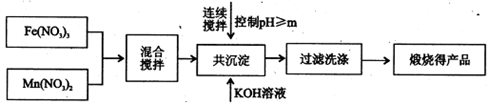
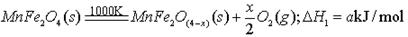
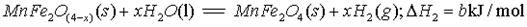
 (填字母编号)。
(填字母编号)。 B.物料可循环使用
B.物料可循环使用