题目内容
雷鸣电闪是日常生活中司空见惯的现象。设某次雷电中,两块云团间的电势差约为109 V,放电电量约为30 C。在闪电过程中,空气中有氮气和氧气直接化合,已知每摩尔氮气和氧气化合时要吸收180.74 kJ的能量,闪电时有1/1000的能量用于这一反应。试求:
(1)此次闪电所产生NO的物质的量为多少?
(2)此次雷雨闪电的生成物相当于给土壤施了多少千克尿素?
(1)此次闪电所产生NO的物质的量为多少?
(2)此次雷雨闪电的生成物相当于给土壤施了多少千克尿素?
(1)3.32×105 mol (2)9.96×103 kg?
此题为物理与化学相结合的学科综合题,具有一定的综合性。根据题意可得闪电放出的能量W="qU=30" C×109 V=3×1010J。由N2(g)+O2(g)====2NO(g);ΔH="+180.74" kJ,知闪电放出的能量可生成NO的物质的量n(NO)=2×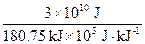 =3.32×105 mol。由NO和CO(NH2)2中N守恒可得关系式:2NO~CO(NH2)2,则3.32×105 mol NO相当于生成的尿素的总质量m〔CO(NH2)2〕=n〔CO(NH2)2〕×M〔CO(NH2)2〕=3.32×105 mol×
=3.32×105 mol。由NO和CO(NH2)2中N守恒可得关系式:2NO~CO(NH2)2,则3.32×105 mol NO相当于生成的尿素的总质量m〔CO(NH2)2〕=n〔CO(NH2)2〕×M〔CO(NH2)2〕=3.32×105 mol×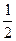 ×60 g·mol-1=9.96×106 g=9.96×103 kg。
×60 g·mol-1=9.96×106 g=9.96×103 kg。
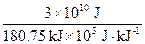 =3.32×105 mol。由NO和CO(NH2)2中N守恒可得关系式:2NO~CO(NH2)2,则3.32×105 mol NO相当于生成的尿素的总质量m〔CO(NH2)2〕=n〔CO(NH2)2〕×M〔CO(NH2)2〕=3.32×105 mol×
=3.32×105 mol。由NO和CO(NH2)2中N守恒可得关系式:2NO~CO(NH2)2,则3.32×105 mol NO相当于生成的尿素的总质量m〔CO(NH2)2〕=n〔CO(NH2)2〕×M〔CO(NH2)2〕=3.32×105 mol×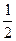 ×60 g·mol-1=9.96×106 g=9.96×103 kg。
×60 g·mol-1=9.96×106 g=9.96×103 kg。
练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
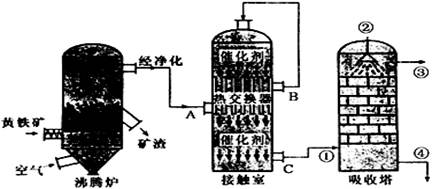
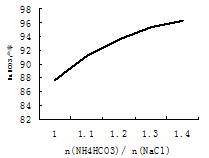


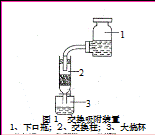
 I3-。如何用化学方法检验有多碘离子生成 。
I3-。如何用化学方法检验有多碘离子生成 。