题目内容
【题目】请按要求回答下列问题:
(1)25 ℃时,向纯水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_____________,由水电离出的c(OH-)=________mol·L-1。
(2)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等pH的a.NaCN溶液、b.Na2CO3溶液和c.CH3COONa溶液,三溶液的浓度由大到小的顺序为___________________________。(用a b c表示)
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_________。
(3)室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
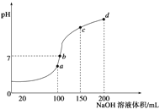
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_____________________________。
【答案】CO32+H2OHCO3+OH、HCO3+H2OH2CO3+OH 10-3 c > a > b NaCN + CO2 + H2O = NaHCO3+ HCN a c(Na+)>c(SO42-) > c(NH4+) > c(H+) = c(OH+)
【解析】
(1)碳酸钠溶液中因碳酸根离子水解导致溶液显碱性,盐溶液中盐的水解促进水的电离;
(2)①根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的浓度越大;
②电离平衡常数越大,酸的酸性越强,根据表中数据可知酸性:H2CO3>HCN>HCO3,向NaCN溶液中通入少量CO2,反应生成HCN和碳酸氢钠,据此写出反应的化学方程式;
(3)a点恰好生成等物质的量的硫酸铵和硫酸钠,水解促进水的电离;b点时pH=7,相对于a点NaOH稍过量,抑制NH4+的水解。
(1)碳酸钠溶液中因碳酸根离子水解导致溶液显碱性,碳酸根水解的离子方程式为CO32+H2OHCO3+OH、HCO3+H2OH2CO3+OH,其pH=11,则c(OH)=10-3mol/L,全部由水电离产生,故答案为:CO32+H2OHCO3+OH、HCO3+H2OH2CO3+OH;10-3;
(2)①根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等pH的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的浓度为:CH3COONa溶液>NaCN溶液>Na2CO3溶液,故答案为:c>a>b;
②根据电离平衡常数大小可知酸性:H2CO3>HCN>HCO3,向NaCN溶液中通入少量CO2,反应生成HCN和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+CO2+H2O =NaHCO3+HCN,故答案为:NaCN+CO2+H2O =NaHCO3+HCN;
(3)图中a、b、c、d四个点,只有a点恰好生成等物质的量的硫酸铵和硫酸钠,铵根离子浓度最大,水解促进水的电离,则水的电离程度最大的是a;b点pH=7,相对于a点NaOH稍过量,抑制NH4+的水解,则溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-) > c(NH4+) > c(H+) = c(OH+),故答案为:a;c(Na+)>c(SO42-) > c(NH4+) > c(H+) = c(OH+)。

 名校课堂系列答案
名校课堂系列答案