题目内容
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s) + 3H2(g)![]() W (s) + 3H2O (g),请回答下列问题:
W (s) + 3H2O (g),请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率______;该反应的平衡常数表达式K=_____。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为______(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2(g)![]() WI4(g)。下列说法正确的有__________。
WI4(g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
【答案】0.3 mol/(L·min) ![]() 60% 吸热 C BD
60% 吸热 C BD
【解析】
(1)由氢气的消耗量与增重质量列关系式计算;反应的化学平衡常数K=![]() ;
;
(2)设氢气的起始体积为a,变化体积为x,由题意建立三段式计算;随温度的升高,H2与水蒸气的体积比减小,说明平衡向正反应方向进行;
(3)化学反应达到化学平衡,正逆反应速率相等,各物质的浓度保持不变;
(4)由所给化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W及I2,生成W附着在还没有挥发的W上,灯管内的I2可循环使用。
(1)设反应消耗氢气的物质的量为x,由方程式可知WO3(s) + 3H2(g)![]() W (s) + 3H2O (g),氢气的消耗量与增重质量的关系为3mol:48g=xmol:4.8g,解得x=0.3,则H2的平均反应速率为
W (s) + 3H2O (g),氢气的消耗量与增重质量的关系为3mol:48g=xmol:4.8g,解得x=0.3,则H2的平均反应速率为![]() = 0.3 (mol/(L·min)),由化学方程式可知反应的化学平衡常数K=
= 0.3 (mol/(L·min)),由化学方程式可知反应的化学平衡常数K=![]() ,故答案为:0.3 (mol/(L·min));
,故答案为:0.3 (mol/(L·min));![]() ;
;
(2)设氢气的起始体积为a,变化体积为x,由题意建立如下三段式:
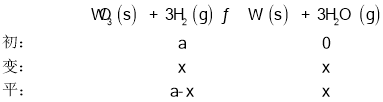
由H2与水蒸气的体积比为2:3可得(a-x):x=2:3,解得x=![]() ,则H2的平衡转化率为
,则H2的平衡转化率为![]() ×100%=60%;随温度的升高,H2与水蒸气的体积比减小,说明平衡向正反应方向进行,该反应为吸热反应,故答案为:60%;吸热;
×100%=60%;随温度的升高,H2与水蒸气的体积比减小,说明平衡向正反应方向进行,该反应为吸热反应,故答案为:60%;吸热;
(3)A、前后气体系数相等,“混合气体的总压强保持不变”不能作为平衡标志,故错误;
B、同向的,不是标志,故错误;
C、因不都是气体,虽体积不变,“混合气体的密度保持不变”只在平衡时,可做标志,故正确;
D、M=m/n, m和n始终不变,不是标志,故错误;
C正确,故答案为:C;
(4)A、温度升高,,WI4的分解速率加快,W和I2的化合速率加快,故错误;
B、高温下,WI4分解生成的W及I2,生成W附着在还没有挥发的W上,故正确;
C、灯管壁温度较低,WI4不会分解,寿命会降低,故错误;
D、由所给化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W及I2,生成W附着在还没有挥发的W上,灯管内的I2可循环使用,故正确;
BD正确,故答案为:BD。

【题目】请按要求回答下列问题:
(1)25 ℃时,向纯水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_____________,由水电离出的c(OH-)=________mol·L-1。
(2)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等pH的a.NaCN溶液、b.Na2CO3溶液和c.CH3COONa溶液,三溶液的浓度由大到小的顺序为___________________________。(用a b c表示)
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_________。
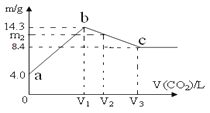
(3)室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
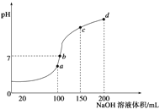
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_____________________________。
【题目】已知:-CHO+(C6H5)3P=CH-R -CH=CH-R + (C6H5)3P=O,R代表原子或原子团,W是一种有机合成中间体,结构简式为:HOOC-CH=CH-CH=CH-COOH,其合成方法如下:
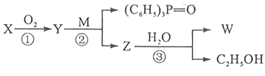
其中,![]() 分别代表一种有机物,合成过程中其他产物和反应条件已略去。
分别代表一种有机物,合成过程中其他产物和反应条件已略去。
X与W在一定条件下反应可以生成酯N,N的相对分子质量为168。
请回答下列问题:
(1)W能发生反应的类型有__________。(填写字母编号)
A.取代反应 | B.水解反应 | C.氧化反应 | D.加成反应 |
(2)写出X与 W在一定条件下反应生成N的化学方程式:___________________。
(3)写出含有3个碳原子且不含甲基的X的同系物的结构简式_________________
(4)写出第②步反应的化学方程式:____________________________________。