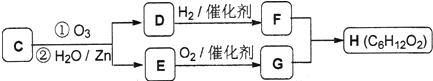
题目内容
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I﹣等)中回收碘,其实验过程如图1: 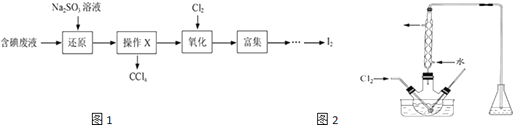
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I﹣ , 其离子方程式为该操作将I2还原为I﹣的目的是 .
(2)操作X的名称为 .
(3)氧化时,在三颈瓶中将含I﹣的水溶液用盐酸调至pH约为2,缓慢通入Cl2 , 在400C左右反应(实验装置如图2所示).实验控制在较低温度下进行的原因是;锥形瓶里盛放溶液作用的为 .
(4)已知:5SO32﹣+2IO3﹣+2H+═I2+5SO42﹣+H2O 某含碘废水(pH约为8)中一定存在I2 , 可能存在I﹣、IO3﹣中的一种或两种.请补充完整检验含碘废水中是否含有I﹣、IO3﹣的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;证明废水中含有I﹣的方法是;证明废水中含有IO3﹣的方法是 . (实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
【答案】
(1)SO32﹣+I2+H2O=2I﹣+2H++SO42﹣;使四氯化碳中的碘进入水层
(2)分液
(3)使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);用NaOH溶液吸收氯气
(4)从水层取少量溶液,加入1﹣2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,若溶液变蓝色,说明废水中含有I﹣ , 否则不含I﹣;另从水层取少量溶液,加入1﹣2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝色,说明废水中含有IO3﹣ , 否则不含IO3﹣
【解析】解:(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘离子,离子反应方程式为SO32﹣+I2+H2O=2I﹣+2H++SO42﹣; 碘微溶于水,而碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子;
所以答案是:SO32﹣+I2+H2O=2I﹣+2H++SO42﹣;使四氯化碳中的碘进入水层;(2)四氯化碳属于有机物,水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;
所以答案是:分液;(3)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气,
所以答案是:使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);用NaOH溶液吸收氯气;(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:
从水层取少量溶液,加入1﹣2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I﹣+2Fe3+=2Fe2++I2 , 若溶液变蓝色,说明废水中含有I﹣ , 否则不含I﹣;
另从水层取少量溶液,加入1﹣2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32﹣+2 IO3﹣+2H+=I2+5SO42﹣+H2O,若溶液变蓝色,说明废水中含有IO3﹣ , 否则不含IO3﹣ ,
所以答案是:从水层取少量溶液,加入1﹣2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,若溶液变蓝色,说明废水中含有I﹣ , 否则不含I﹣;另从水层取少量溶液,加入1﹣2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝色,说明废水中含有IO3﹣ , 否则不含IO3﹣ .

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5molL﹣1 盐酸、0.55molL﹣1NaOH溶液,尚缺少的实验玻璃用品是、 .
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”).
(3)他们记录的实验数据如下:已知:Q=Cm(t2﹣t1),反应后溶液的比热容C为4.18kJ℃﹣1kg﹣1 , 各物质的密度均为1gcm﹣3 . ①计算完成下表.(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 中和热△H | ||
t1 | t2 | ||||
① | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将(填“变大”或“变小”或“无影响”).
【题目】运用化学反应原理分析解答以下问题:
(1)弱酸在水溶液中存在电离平衡,部分0.1molL﹣1弱酸的电离平衡常数如下表:
弱酸 | 电离平衡常数(25℃) |
HClO | K=2.98×10﹣8 |
H2CO3 | K1=4.3×10﹣7 |
H2SO3 | K1=1.54×10﹣2 |
①当弱酸的浓度一定时,降低温度,K值(填“变大”“变小”或“不变”).
②下列离子方程式和有关说法错误的是 .
a.少量的CO2通入次氯酸钠溶液中:2ClO﹣+H2O+CO2═2HClO+CO32﹣
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32﹣═2HCO3﹣+SO32﹣
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
d.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: .
(2)工业废水中常含有一定量的Cr2O72﹣和CrO42﹣ , 它们对人类及生态系统会产生很大损害,必须进行处理后方可排放. ①在废水中存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O.若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是 .
a.平衡常数K值可以不改变
b.达到新平衡CrO42﹣的消耗速率等于Cr2O72﹣的消耗速率
c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
②Cr2O72﹣和CrO42﹣最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH﹣(aq),常温下Cr(OH)3的Ksp=10﹣32 , 当c(Cr3+)降至10﹣3 molL﹣1 , 溶液的pH调至4时,(填“有”或“没有”)沉淀产生.
(3)已知:①2CH3OH(g)CH3OCH3(g)+H2O(g) ②CO(g)+2H2(g)CH3OH(g)
③CO(g)+H2O(g) CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为K1、K2、K3 , 则该温度下反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)的化学平衡常数K=(用含K1、K2、K3的代数式表示).向某固定体积的密闭容器中加入3mol CO和3mol H2 , 充分反应后恢复至原温度,测定容器的压强为反应前的 ![]() ,则CO的转化率为 .
,则CO的转化率为 .