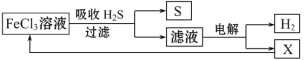
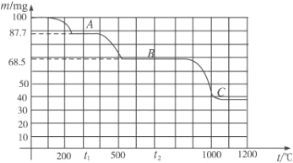
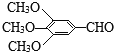
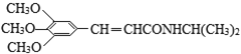题目内容
【题目】在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是( )
A.0.1mol.L-1.min-1
B.0.2mol.L-1.min-1
C.0.3mol.L-1.min-1
D.0.6mol.L-1.min-1
【答案】B
【解析】
试题分析:氮气的浓度的变化量是1.8mol/L-0.8mol/L=1.0mol/L,所以根据方程式N2+3H2![]() 2NH3可知生成氨气的浓度是2.0mol/L,则在这10min内NH3的平均反应速率是2.0mol/L÷10min=0.2mol/(L·min),答案选B。
2NH3可知生成氨气的浓度是2.0mol/L,则在这10min内NH3的平均反应速率是2.0mol/L÷10min=0.2mol/(L·min),答案选B。

练习册系列答案
相关题目