题目内容
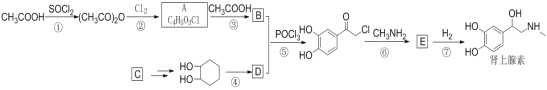
【题目】电化学降解治理水中硝酸盐的污染,在酸性条件下,电解的原理如图所示
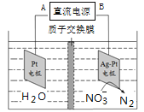
(1)A极为________极;
(2)阴极电极反应式为 _________________。
【答案】正 2NO3- + 10e- +12H+ = N2 ↑+ 6H2O
【解析】
(1)由图示反应产物判断电解池右侧是阴极区,则可判断电源A极的名称;
(2)阴极上硝酸根离子被还原,据此写电极反应式;
(1)由图知,电解池右侧硝酸根离子转变为氮气,发生还原反应,则右侧是阴极区,则可判断电源B极为负极,则A极为正极;
答案为:正;
(2)阴极上硝酸根离子被还原,在酸性条件下,氢离子参与反应,得到氮气和水,据此写电极反应式为:2NO3- + 10e- +12H+ = N2 ↑+ 6H2O;
答案为:2NO3- + 10e- +12H+ = N2 ↑+ 6H2O。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性