题目内容
【题目】请根据所学知识回答下列问题:
(1)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1____________ΔH2(填“>”“<”或“=”下同)。
(2)相同条件下,2 mol氢原子所具有的能量____________1 mol 氢分子所具有的能量。
(3)已知:常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol可溶正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为_______________
(4)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
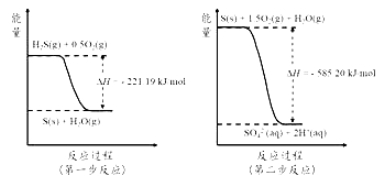
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(5)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
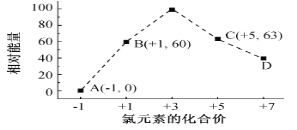
①D是______________________ (填离子符号)。
②B→A+C反应的热化学方程式为______________________ (用离子符号表示)。
【答案】
(1)=;(2)>;(3)ΔH=+45.2 kJmol-1;
(4)H2S(g)+2O2(g)=SO42-(aq)+H+(aq) ΔH=-806.39 kJmol-1
(5)①ClO4-;②3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol;
【解析】
试题分析:
(1)反应热与反应物的总能量和生成物的总能量,与反应条件无关,则光照和点燃条件的△H相同。
(2)氢气分子生成氢原子要破坏化学键,需要吸热,则2mol氢原子所具有的能量大于1mol氢分子所具有的能量。
(3)常温下,0.01molL-1 MOH溶液的pH为10,说明MOH是弱碱:MOH(aq)+H+(aq)═M+(aq)+H2O(l)△H1=-12.1 kJmol-1①,H+(aq)+OH-(aq)═H2O(l)△H2=-57.3 kJmol-1②,根据盖斯定律,由①-②得:MOH(aq)M+(aq)+OH-(aq)△H=(-12.1+57.3)kJmol-1=+45.2 kJmol-1。
(4)由两步反应的能量变化示意可以看出,H2S先被氧化为S(s)释放能量,H2S(g)+0.5O2(g)===S(s)+H2O(g) ΔH =-221.19 kJ·mol-1,然后S再被进一步氧化为 SO42-(aq)释放能量:S(s)+1.5O2(g)+H2O(g)===SO42-(aq)+ 2H+(aq) ΔH =-585.20 kJ·mol-1,根据盖斯定律,将两个热方程式相加可得1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式,即:H2S(g)+2O2(g)=SO42-(aq)+H+(aq) ΔH=-806.39 kJmol-1
(5)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-;②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以该热化学反应方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案