题目内容
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、NO3-、Cl2都可在该物质的溶液中大量共存
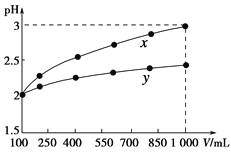
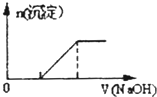
B.向0.1mo1·L-1该物质的溶液中滴加0.1mol·L-1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+3Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
【答案】C
【解析】
A. Fe2+可被Cl2氧化而不能共存;
B. 滴加氢氧化钠溶液,Fe2+先与OH-生成沉淀;
C. Fe3+遇KSCN会产生红色物质;
D. 向溶液中滴加Ba(OH)2溶液,NH4+也可与OH-反应。
A.(NH4)2Fe(SO4)2中含有Fe2+,Fe2+可被Cl2氧化而不能大量共存, A项错误;
B.滴加NaOH溶液,首先Fe2+先与OH-反应生成白色沉淀, B项错误;
C.滴入几滴KSCN溶液,若溶液变红色,说明Fe2+被氧化为Fe3+, C项正确;
D.恰好使S042-完全沉淀的离子方程式为:2NH4++Fe2++2SO42-+3Ba2++4OH-=2BaSO4↓+Fe(OH)2↓+2NH3↑+2H2O, D项错误;
答案选C。

练习册系列答案
相关题目