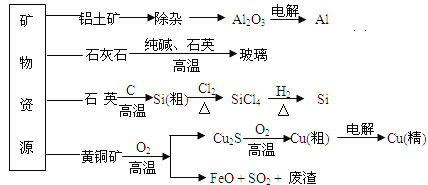
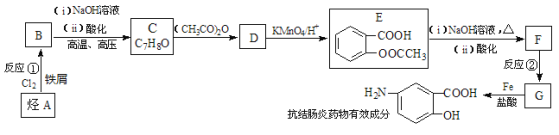
��Ŀ����
����Ŀ���������� A �� NaH ������Ҫ�Ļ�ԭ������ˮ��ǿ�ҷ�Ӧ��һ�������£�2.4g NaH ������ B ��Ӧ���� 3.9g ������ A �� 2.24L��������ɱ�״������ H2����֪���� B ��ʹʪ���ɫʯ����ֽ��������ش��������⣺
��1��B �Ļ�ѧʽ��_____��
��2��NaH ������ B ��Ӧ���ɻ����� A �Ļ�ѧ����ʽ_____���÷�Ӧ�� A ��_____��
A.�������� B.��ԭ���� C.�Ȳ�����������Ҳ���ǻ�ԭ����
��3��0.1molA ���������ᷢ����������ԭ��Ӧ������� HCl_____mol
��4���ڸ������⻯�ƣ�NaH���ɽ����Ȼ��ѣ�TiC14����ԭ�ɽ����ѣ�ͬʱ�õ�������壬 �����ƽ��Ħ������Ϊ 25 g/mol��д���÷�Ӧ�Ļ�ѧ����ʽ_____��
���𰸡�NH3 NaH+NH3=NaNH2+H2 C 0.2 mol 8NaH+3TiCl4![]() 3Ti+2H2+4HCl+8NaCl
3Ti+2H2+4HCl+8NaCl
��������
��֪����B��ʹʪ���ɫʯ����Һ������B�ǰ�����2.40gNaH�����ʵ���Ϊ0.1mol�Ͱ���B��Ӧ����3.90g������A��0.1molH2�����������غ㣬���뷴Ӧ�İ��������ʵ���Ϊ0.1mol�����������غ���A��ѧʽΪNaNH2���ɴ˷������
(1)���� B ��ʹʪ���ɫʯ����ֽ��������B Ϊ��������ѧʽ��NH3��
(2)NaH������B��Ӧ���ɻ�����A�Ļ�ѧ����ʽ��NaH+NH3=NaNH2+H2��NaH��HԪ�ش�-1������Ϊ0�ۣ�NH3�в���HԪ�ش�+1�۽�Ϊ0�ۣ���NaNH2�Ȳ�����������Ҳ���ǻ�ԭ����ʴ�ΪC��
(3)NaNH2���������ᷢ����������ԭ��Ӧ�Ļ�ѧ����ʽNaNH2+2HCl=NaCl+NH4Cl����0.1molNaNH2�μӷ�Ӧ������� HCl0.2mol��
(4)�ڸ�����(NaH)�ɽ����Ȼ���(TiCl4)��ԭ�ɽ����ѣ�ͬʱ�õ�������壬˵���������ijɷ���H2��HCl��Cl2��HCl����������H2��Cl2��H2��Cl2��HCl�������ƽ��Ħ������Ϊ 25 g/mol����������ijɷ�ֻ����H2��HCl����������������ʵ���Ϊ1mol��H2Ϊnmol�����������������Ϊ25g����2n+36.5(1-n)=25����ã�n=![]() �����û��������H2��HCl�����ʵ���֮��Ϊ
�����û��������H2��HCl�����ʵ���֮��Ϊ![]() ��
��![]() =1:2����ϵ����غ��ԭ���غ�ø÷�Ӧ�Ļ�ѧ����ʽΪ8NaH+3TiCl4
=1:2����ϵ����غ��ԭ���غ�ø÷�Ӧ�Ļ�ѧ����ʽΪ8NaH+3TiCl4![]() 3Ti+2H2+4HCl+8NaCl��
3Ti+2H2+4HCl+8NaCl��

 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�