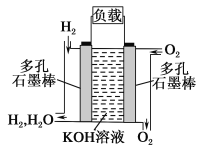
题目内容
【题目】一种肼燃料电池的结构如图所示,下列说法正确的是( )
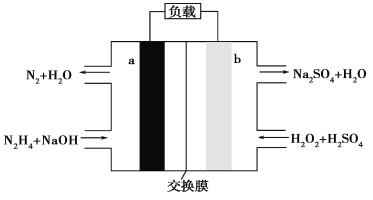
A. a极是正极,电极反应式为N2H4-4e-+4OH-=N2↑+4H2O
B. 电路中每转移NA个电子,就有1mol Na+穿过膜向正极移动
C. b极的电极反应式为H2O2+2e-=2OH-
D. 用该电池作电源电解饱和食盐水,当得到0.1mol Cl2时,至少要消耗0.1mol N2H4
【答案】B
【解析】
根据图知,a电极上N元素化合价由-2价变为0价,所以a是负极,则b是正极,负极反应式为N2H4-4e-+4OH-=N2↑+4H2O,正极上电极反应式为H2O2+2e-+2H+=2H2O。
A.a电极上N元素化合价由-2价变为0价,所以a是负极,负极反应式为N2H4-4e-+4OH-=N2↑+4H2O,A错误;
B.电路中每转移6.02×1023个电子,根据电荷守恒知,有1molNa+穿过膜向正极移动,B正确;
C.酸性溶液中不能得到OH-,b电极反应式为H2O2+2e-+2H+=2H2O,C错误;
D.阳极上生成标况下2.24L氯气,其物质的量是0.1mol,根据转移电子守恒得肼的物质的量=![]() =0.05mol,D错误;
=0.05mol,D错误;
故合理选项是B。

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目