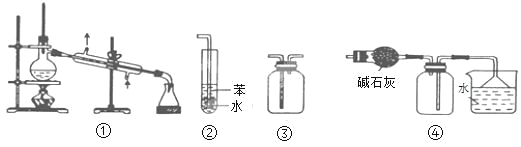
��Ŀ����
����Ŀ��±�����Ҫ�ɷ���MgCl2 �� �����Fe2+��Fe3+��Mn2+���������ӣ���±��Ϊԭ�ϰ���ͼ��ʾ���̽������������Ƶ���������þ�� 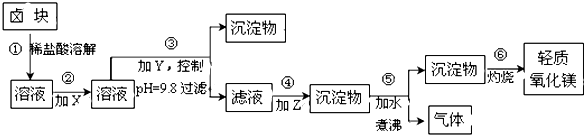
�������ϵ��±�������ݣ�
��1�������������������pH | ��2��ԭ�ϼ۸�� | |||
���� | ��ʼ���� | ������ȫ | ���� | �۸�Ԫ/�֣� |
Fe��OH��3 | 2.7 | 3.7 | a��ƯҺ����25.2%NaClO�� | 450 |
Fe��OH��2 | 7.6 | 9.6�~ | b��˫��ˮ����30%H2O2�� | 2400 |
Mn��OH��2 | 8.3 | 9.8 | c���ռ��98%NaOH�� | 2100 |
Mg��OH��2 | 9.6 | 11.1 | d�������99.5%Na2CO3�� | 600 |
�~Fe2+�����������״�����״���Һ�г�ȥ�����뽫����������Fe��OH��3������ʽ���ܳ�����
��Ҫ���Ʒ�������������������ɱ��ϵͣ�������ϱ��ṩ�����ϻش�
��1�������м�����Լ�X��Y��Z���ѡ�������DZ�2�е���ѡ���Լ���ţ���
��2������ڷ�����Ӧ�����ӷ���ʽΪ��������з�����Ӧ�Ļ�ѧ����Ϊ ��
��3������ۿ���pH=9.8��Ŀ���� ��
��4������ʵ���ҽ��в��������ʵ�飬�����õ��������������š��ƾ���ơ��������ǣ�
��5����̽��Mg��OH��2�ܽ��Ե�ʵ���У�������װ������Mg��OH��2��Һ���Թ��м�������NH4Cl���壬�������Һ�����壬���û�ѧƽ���ԭ��������Һ������ԭ�� ��
���𰸡�
��1��acd
��2��2Fe2++ClO��+2H+=Cl��+2Fe3++H2O��MgCO3+H2O ![]() Mg��OH��2��+CO2��
Mg��OH��2��+CO2��
��3��ʹMg2+��������ʾ����ܳ���ת��Ϊ������ȥ
��4������
��5��Mg��OH��2��s��?Mg2+��aq��+2OH����aq����NH4Cl �������NH4+��OH����ϳ��������NH3?H2O��������c��OH������Mg��OH��2�ܽ�ƽ�������ƶ�
���������⣺��1.���������Ϊ�˽�Fe2+������Fe3+ �� ���ڿ��ƺ��ʵ�pH����ʱ����Fe��OH��3��������֮����ȻƯҺ��H2O2���ɲ��ã����Աȱ�2�ṩ��ԭ�ϼ۸���Կ�����ƯҺ��H2O2�ļ۸�͵ö࣬����ѡƯҺ���������XΪƯҺ������Y��Ŀ���ǵ���pH��ѡ���������ƣ���YΪ�ռ����Z��Ŀ����ʹþ���ӳ�����ZΪ������Դ��ǣ�acd��
��2.�������м������������������Һ�л�������������Ϊ�����ӣ���Ӧ�����ӷ���ʽΪ��2Fe2++ClO��+2H+=2Fe3++Cl��+H2O��
�����Z����Ϊ������Բ�������ɵij�������MgCO3 �� ���Գ�����MgCO3����е�����·���ˮ�⣬����Mg��OH��2��CO2���壬��Ӧ�Ļ�ѧ����ʽΪ��MgCO3+H2O ![]() Mg��OH��2��+CO2�������Դ��ǣ�2Fe2++ClO��+2H+=Cl��+2Fe3++H2O��MgCO3+H2O
Mg��OH��2��+CO2�������Դ��ǣ�2Fe2++ClO��+2H+=Cl��+2Fe3++H2O��MgCO3+H2O ![]() Mg��OH��2��+CO2����
Mg��OH��2��+CO2����
��3.������۵�Ŀ������ʹ��Mg2+����ĸ������ʽ������Ӷ�������������������Ա�ͨ�����˶���ȥ��Ӧ����NaOH������봿����ܴﵽ�ϸߵ�PH��������1�ṩ�����ݣ���ȥ�������Ӻ�����pH��Χ��3.7��pH��9.8���ڴ˷�Χ�ڣ����pH���ߣ��ͻ��д�����Mg2+����Mg��OH��2����������У��Ӷ����������ɱ�����ߣ�Ϊ�˼�˲�Ʒ�����������ɱ���ѡ��pH=9.8���������Ȼ��ʱMg2+Ҳ�Ჿ������Mg��OH��2������������±��۸��������㲻�ɱ������ʧ���ǿ��Գ��ܵģ��Դ˱�֤��Ʒ�Ĵ��ȣ����Դ��ǣ�ʹ��Mg2+����ĸ������ʽ������Ӷ���Ϊ������������Ա��ȥ��
��4.���������������þ�����Ʊ�����þ��Ӧ�������µ������н��У����Դ��ǣ�������
��5.��������þ��Һ�д����ܽ�ƽ��Mg��OH��2Mg 2++2OH�� �� Mg��OH��2���������OH����NH4+��������ѵ�����������NH3H2O������������Ũ�Ƚ��ͣ��Ӷ�ʹMg��OH��2���ܽ�ƽ�������ƶ����ٽ�������þ�ܽ⣬��Mg��OH��2������NH4Cl��Һ�У����Դ��ǣ�Mg��OH��2��s��Mg2+��aq��+2OH����aq����NH4Cl �������NH4+��OH����ϳ��������NH3H2O��������c��OH������Mg��OH��2�ܽ�ƽ�������ƶ���

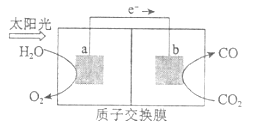
����Ŀ�����и��������У������������ͼʾ������һ��������һ��ת����ϵ�����Ϊ
��� | X | Y | Z | W |
|
A | Al | AlCl3 | Al(OH)3 | Al2O3 | |
B | Na | Na2O2 | Na2CO3 | NaCl | |
C | Fe | FeCl2 | FeCl3 | Fe(OH)3 | |
D | Si | Na2SiO3 | H2SiO3 | SiO2 |
A. A B. B C. C D. D
����Ŀ��25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L����Һ����pH���±���ʾ���й�˵����ȷ����
��� | �� | �� | �� | �� |
��Һ |
|
|
|
|
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A. ����ǿ���� ![]()
B. ���ӵ���Ũ�ȣ���>��
C. ���� ![]()
D. �ں͢���![]() ���
���