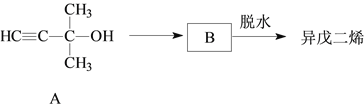
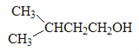题目内容
【题目】PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A. Cu+2Fe3+=CU2+ + Fe2+ B. 10Cl- +2KMnO4- +16H+=2Mn2+ +5Cl2↑+8H2O
C. 2Fe2+ +Cl2=2Fe3+ +2Cl- D. 5Pb2+ +2MnO4- +2H2O=5PbO2+2Mn2+ +4H+
【答案】D
【解析】
A. 铁离子氧化性强于铜,反应可以发生,A正确;B. 高锰酸钾的氧化性强于氯气,反应可以发生,B正确;C. 氯气氧化性强于铁离子,反应可以发生,C正确;D. 二氧化铅的氧化性强于高锰酸钾,反应不能发生,D错误,答案选D。

【题目】卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁. 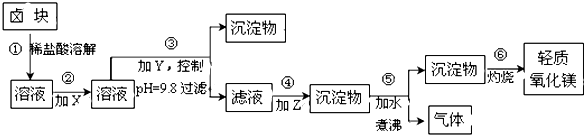
查阅资料得下表相关数据:
表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽.
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X,Y,Z最佳选择依次是表2中的(选填试剂编号).
(2)步骤②发生反应的离子方程式为;步骤⑤中发生反应的化学方程为 .
(3)步骤③控制pH=9.8的目的是 .
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因 .