题目内容
【题目】氮及其化合物在工业生产中有广泛用。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为___(填化学式)。
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:__________________。
(3)已知以下热化学方程式: 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH1
2NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g)![]() N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3
①ΔH3=______________________(用ΔH1、ΔH2表示)。
②一定温度下,在恒容密闭容器中进行反应:3NO2(g)![]() N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________。
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________。
A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D.![]() 保持不变
保持不变
(4)在密闭容器中充入NO,发生反应2NO(g)![]() N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
①ΔH________0。(填“>”“<”或“=”)
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是_________。
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
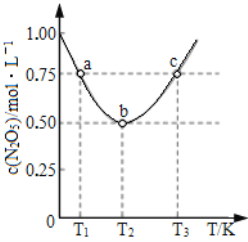
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g)![]() 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________(填“增大”“减小”或“不变”)。
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________(填“增大”“减小”或“不变”)。
【答案】 N2O或NH4NO3 N2O22-+H2O![]() HN2O2-+OH- -
HN2O2-+OH- - ![]() ACD < B 1 mol3·L-3 减小
ACD < B 1 mol3·L-3 减小
【解析】试题(1)因为金属为2价,所以氧化后需要2摩尔的硝酸和金属结合,又因为金属与硝酸所消耗的物质的量的比为2:5,所以2摩尔的金属就需要4摩尔的硝酸形成盐,那么还有1摩尔的硝酸被还原;若还原产物是硝酸铵,则被还原的硝酸是0.5mol。(2)向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色,说明Na2N2O2是强碱弱酸盐,N2O22-水解;(3)①根据盖斯定律计算ΔH3;②根据平衡标志分析;(4) ①升高温度,平衡常数K减小,说明平衡逆向移动;②反应前后气体物质的量是相等,反应达到平衡之后,仅缩小容器体积,平衡不移动;(5)利用“三段式”计算平衡常数;再向容器中充入少量的N2O5气体,相当于加压;
解析:(1)因为金属为2价,所以氧化后需要2摩尔的硝酸和金属结合,又因为金属与硝酸所消耗的物质的量的比为2:5,所以2摩尔的金属就需要4摩尔的硝酸形成盐,那么还有1摩尔的硝酸被还原,设还原产物中N元素的化合价是x,根据得失电子守恒2×2=1×(5-x);x=+1,所以还原产物是N2O;若还原产物是硝酸铵,则被还原的硝酸是0.5mol,N元素化合价由+5降低为-3,所以原产物可能是硝酸铵。(2)向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色,说明Na2N2O2是强碱弱酸盐,N2O22-水解,水解离子方程式是N2O22-+H2O![]() HN2O2-+OH-;(3)①2N2O5(g)
HN2O2-+OH-;(3)①2N2O5(g)![]() 4NO2(g)+O2(g) ΔH1;②2NO(g)+O2(g)=2NO2(g) ΔH2
4NO2(g)+O2(g) ΔH1;②2NO(g)+O2(g)=2NO2(g) ΔH2
根据盖斯定律―①×![]() ―②×
―②×![]() 得3NO2(g)
得3NO2(g)![]() N2O5(g)+NO(g) ΔH3=-
N2O5(g)+NO(g) ΔH3=- ![]() ;②A.反应前后气体物质的量是变量,所以容器内总压强保持不变达到平衡状态,故A正确; B.容器内气体质量不变,根据
;②A.反应前后气体物质的量是变量,所以容器内总压强保持不变达到平衡状态,故A正确; B.容器内气体质量不变,根据![]() ,密度是恒量,所以容器内气体密度保持不变,不一定平衡,故B错误; C.根据v正(NO2)∶v逆(N2O5)=3∶1,正逆反应速率比等于系数比,一定达到平衡状态,故C正确; D.Q=
,密度是恒量,所以容器内气体密度保持不变,不一定平衡,故B错误; C.根据v正(NO2)∶v逆(N2O5)=3∶1,正逆反应速率比等于系数比,一定达到平衡状态,故C正确; D.Q=![]() ,Q不变时,即Q=K时,达到平衡状态,故D正确; (4) ①升高温度,平衡常数K减小,说明平衡逆向移动,所以正反应放热,ΔH<0;②2NO(g)
,Q不变时,即Q=K时,达到平衡状态,故D正确; (4) ①升高温度,平衡常数K减小,说明平衡逆向移动,所以正反应放热,ΔH<0;②2NO(g)![]() N2(g)+O2(g)反应达到平衡之后;A.仅缩小容器体积,NO的浓度增大,故A错误; B. 反应前后气体物质的量是相等,反应达到平衡之后,仅缩小容器体积,平衡不移动,所以NO的转化率不变化,故B正确; C.缩小容器体积,压强增大,所以正、逆反应速率均增大,故C错误; D.缩小容器体积,压强增大,故D错误。(5)根据图示,T2K时N2O5的浓度是0.5mol/L,
N2(g)+O2(g)反应达到平衡之后;A.仅缩小容器体积,NO的浓度增大,故A错误; B. 反应前后气体物质的量是相等,反应达到平衡之后,仅缩小容器体积,平衡不移动,所以NO的转化率不变化,故B正确; C.缩小容器体积,压强增大,所以正、逆反应速率均增大,故C错误; D.缩小容器体积,压强增大,故D错误。(5)根据图示,T2K时N2O5的浓度是0.5mol/L,
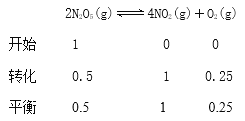
![]() mol3·L-3 ;再向容器中充入少量的N2O5气体,相当于加压,达到新平衡时N2O5的转化率会减小。
mol3·L-3 ;再向容器中充入少量的N2O5气体,相当于加压,达到新平衡时N2O5的转化率会减小。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案