题目内容
17.下列各组物质中,两种物质所含化学键类型不同的是( )| A. | H2O和HNO3 | B. | NaCl和NH3 | C. | CaF2和CsF | D. | Cl2和O2 |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物含有离子键,可能含有共价键,共价化合物只含共价键.
解答 解:A、H2O和HNO3都是共价化合物,都含有共价键,故A错误;
B、NaCl只含有离子键,NH3中只含有极性共价键,两种物质所含化学键类型不同,故B正确;
C、CaF2和CsF都是离子化合物,都含有离子键,故C错误;
D、Cl2和O2都是单质,都含有共价键,故D错误.
故选B.
点评 本题考查化学键类型的判断,题目难度不大,注意离子键和共价键的区别.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
7.下列反应属于吸热反应的是( )
①二氧化碳与赤热的炭反应生成一氧化碳
②液态水汽化
③锌粒与稀H2SO4反应制取H2
④Ba(OH)2•8H2O固体与NH4Cl固体反应
⑤生石灰跟水反应.
①二氧化碳与赤热的炭反应生成一氧化碳
②液态水汽化
③锌粒与稀H2SO4反应制取H2
④Ba(OH)2•8H2O固体与NH4Cl固体反应
⑤生石灰跟水反应.
| A. | ①②④ | B. | ①⑤ | C. | ①③④⑤ | D. | ①④ |
8.某烃的组成为C15H24,分子结构非常对称.有关实验证明该烃中仅存在三种基团:乙烯基(-CH=CH2),亚甲基(-CH2-)和次甲基(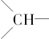 ),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
 ),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )| A. | 4、6 | B. | 2、3 | C. | 3、6 | D. | 3、3 |
12.下列叙述中,正确的是( )
| A. | 离子化合物中不含共价键 | |
| B. | 共价化合物中不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性键不是化学键 |
2.下列各组物质中,互为同分异构体的是( )
| A. | 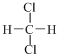 和 和 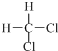 | B. | 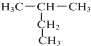 和 和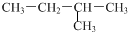 | ||
| C. | CH3CH2CH3和CH2=CHCH3 | D. | 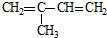 和 和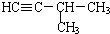 |
3.工业上制取CuCl2的生产流程如图:
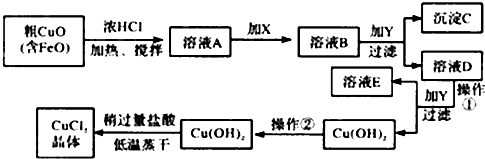
请结合表数据,回答下列问题:
①溶液A中加入X是一种“绿色”氧化剂,则X是NaClO(填化学式),其目的是氧化Fe2+生成Fe3+ 有利于沉淀分离.
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.

请结合表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.
20.关于同分异构体的叙述正确的是( )
| A. | 相对分子质量相同而结构不同的化合物互称为同分异构体 | |
| B. | 分子式相同而结构不同的化合物互称为同分异构体 | |
| C. | 同分异构体之间由于分子组成相同,所以它们的性质相同 | |
| D. | 只有少数的有机物之间存在同分异构现象 |
1.下列5种烃:①2-甲基戊烷 ②2,2-二甲基丙烷 ③己烷 ④庚烷 ⑤戊烷,按它们的沸点由高到低的顺序排列正确的是( )
| A. | ①>②>③>④>⑤ | B. | ②>③>⑤>④>① | C. | ④>③>②>①>⑤ | D. | ④>③>①>⑤>② |
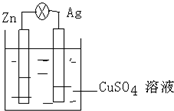 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.