题目内容
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质:

(1)装置A中烧瓶内试剂可选用________(填序号)。
a.浓硫酸 b.碱石灰 c.五氧化二磷 d.NaOH固体
(2)若探究氨气的溶解性,标准状况下,装置D中收集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________;完成喷泉实验后,装置D中充满液体,则装置D中溶液的物质的量浓度为__________。(保留两位有效数字)
(3)K2的导管末端需要连接氨气的吸收装置,则不能在K2的导管末端连接如图中的________装置(填序号Ⅰ、Ⅱ、Ⅲ)。
备选装置(其中水中含酚酞试液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(4)若探究氨气的还原性,需关闭K1、K3,K2处导管连接制取纯净、干燥氯气的装置。
①D中氨气与氯气反应产生白烟,同时生成一种化学性质稳定气体单质,该反应可用来检验氯气管道是否有泄漏,则该反应的化学方程式为______。
②尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中吸收氯气发生的化学方程式为_____。
【答案】bd 用热毛巾捂住烧瓶一段时间 0.045 mol/L I 8NH3 + 3Cl2 = N2 + 6NH4Cl Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1) a.浓硫酸与氨水反应生成硫酸铵和水,不行,a错误;
b.碱石灰遇水放热,温度升高,一水合氨分解产生氨气,b正确;
c.五氧化二磷是酸性氧化物,把氨水反应了,c错误;
d.NaOH固体遇水放热,温度升高,一水合氨分解产生氨气,d正确;
故答案为:bd;
(2)想办法让一部分氨气与烧杯中的水接触,可用热毛巾捂住烧瓶一段时间,可引发喷泉实验,设烧瓶D的体积为1L,则氨气的物质的量=![]() mol,溶于水后溶质的物质的量浓度=
mol,溶于水后溶质的物质的量浓度=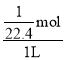 ≈0.045mol/L,故答案为:用热毛巾捂住烧瓶一段时间;0.045 mol/L;
≈0.045mol/L,故答案为:用热毛巾捂住烧瓶一段时间;0.045 mol/L;
(3)氨气极易溶于水,易引发倒吸,要加防倒吸装置,Ⅱ和Ⅲ均可防倒吸,Ⅰ不行,故答案为:Ⅰ;
(4)①氯气有强氧化性,氨气中N的化合价为-3,有还原性,被氯气氧化成稳定的氮气,氯气被还原成-1价,另一个产物为NH4Cl,所以,反应的方程式为:8NH3 + 3Cl2 = N2 + 6NH4Cl,故答案为:8NH3 + 3Cl2 = N2 + 6NH4Cl;
②吸收氯气常用NaOH溶液,故反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)=___________;用离子方程式表示FeCl3溶液用于净水的原因:______________________。
(2)已知NaHSO4在水中的电离方程式 NaHSO4 = Na++H++SO42-。在NaHSO4溶液中c(H+)______c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢 钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______7
(3)分析下表提供的数据:
化学式 | 电离常数 |
HClO | Ka=3×10-8 |
H2CO3 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
①84消毒液(有效成分为NaClO)久置于空气中会失效,写出发生反应的离子方程式: _____________________________________________
②判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序: ____________