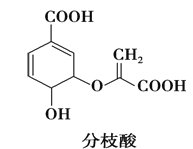
题目内容
【题目】含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A. 被氧化的砒霜为1.98 mg
B. 分解产生的氢气为 0.672 mL
C. 和砒霜反应的锌为3.90 mg
D. 生成砷化氢时,转移的电子总数为6×10-5NA
【答案】C
【解析】A.反应中As元素化合价由As2O3中+3价降低为AsH3中-3价,砒霜发生还原反应,故A错误;B.生成As的物质的量=![]() =2×10-5mol,根据原子守恒可知分解的AsH3为2×10-5mol,由H原子守恒可知生成氢气为
=2×10-5mol,根据原子守恒可知分解的AsH3为2×10-5mol,由H原子守恒可知生成氢气为![]() =3×10-5mol,故标况下,分解产生氢气体积为3×10-5mol×22.4L/mol=6.72×10-4L=0.672 mL,但氢气所处的状态不一定是标准状况,故其体积不一定是0.672 mL,故B错误;C.根据电子转移守恒,可知参加反应Zn的物质的量=2×10-5mol×[3-(-3)]÷2=6×10-5mol,故参加反应Zn的质量=6×10-5mol×65g/mol=3.9×10-3g=3.9mg,故C正确;D.整个过程中,As元素化合价由As2O3中+3价降低为AsH3中-3价,AsH3中-3价升高为As中0价,故整个过程转移电子总数为2×10-5mol×(6+3)×NAmol-1=1.8×10-4NA,故D错误;故选C。
=3×10-5mol,故标况下,分解产生氢气体积为3×10-5mol×22.4L/mol=6.72×10-4L=0.672 mL,但氢气所处的状态不一定是标准状况,故其体积不一定是0.672 mL,故B错误;C.根据电子转移守恒,可知参加反应Zn的物质的量=2×10-5mol×[3-(-3)]÷2=6×10-5mol,故参加反应Zn的质量=6×10-5mol×65g/mol=3.9×10-3g=3.9mg,故C正确;D.整个过程中,As元素化合价由As2O3中+3价降低为AsH3中-3价,AsH3中-3价升高为As中0价,故整个过程转移电子总数为2×10-5mol×(6+3)×NAmol-1=1.8×10-4NA,故D错误;故选C。

 阅读快车系列答案
阅读快车系列答案【题目】钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: 。
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过 ;废渣中的主要成分除了LiF外,还有 。
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是 。
(4)在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4·2H2O)=183g/mol
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是 。温度高于890℃时,固体产物发生分解反应,固体产物为 。