题目内容
【题目】某酸HA是一元弱酸,25℃时的电离平衡常数Ka=4.0×10-8。
(1)写出该酸的电离方程式___,其电离平衡常数表达式Ka=____。
(2)25℃时,向1mol·L-1HA溶液中加入1 mol·L-1 盐酸,会____(“抑制”或“促进”)HA的电离,c(H+)____(填“增大”、“减小”或“不变”), 电离平衡常数Ka___(填“增大”、“减小”或“不变”)。
(3)25℃时,若HA的起始浓度为0.01mol·L-1,则平衡时c(H+)=___mol/L。
【答案】HA![]() H++A-
H++A- ![]() 抑制 增大 不变 2.0×10-5
抑制 增大 不变 2.0×10-5
【解析】
(1)HA是一元弱酸,电离时分子与离子共存;
(2)根据勒夏特列原理判断;温度未变,则Ka不变;
(3)根据Ka=![]() 计算。
计算。
(1)HA是一元弱酸,电离时分子与离子共存,则电离方程式为HA![]() H++A-;Ka=
H++A-;Ka=![]() ;
;
(2)25℃时,向1mol·L-1HA溶液中加入1 mol·L-1 盐酸,导致溶液中的氢离子浓度增大,则平衡向氢离子浓度减小的方向移动,即抑制HA的电离,但c(H+)增大;温度未变,则Ka不变;
(3)Ka=![]() ,c(HA)=0.01mol/L,c(H+)= c(A-),则c2(H+)= Ka
,c(HA)=0.01mol/L,c(H+)= c(A-),则c2(H+)= Ka![]() c(HA)=0.01×4.0×10-8=4.0×10-10,c(H+)=2.0×10-5 mol/L。
c(HA)=0.01×4.0×10-8=4.0×10-10,c(H+)=2.0×10-5 mol/L。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
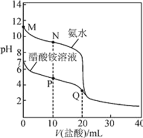
单元加期末复习先锋大考卷系列答案【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定)。下列说法正确的是( )
实验序号 | 甲针筒内物质 | 乙针筒内物质 |
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
![]()
A.上述4个实验均发生了氧化还原反应
B.实验2,甲针筒内最终的无色气体是NO
C.实验3,甲针筒内充满黄绿色气体
D.实验4,甲针筒内活塞将向右移动
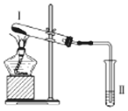
【题目】按如图装置进行实验,下列推断正确的是( )
选项 | I中试剂 | II中试剂及现象 | 推断 | |
A | 铁粉与湿棉花 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
|
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 | |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油分解产物中含有不饱和烃 | |
D | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
A.AB.BC.CD.D
【题目】下表中对应关系错误的是( )
A | NaCl=Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO HCO | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色; SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH=NaCl+NaClO+H2O; 3S+6NaOH=2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
A.AB.BC.CD.D