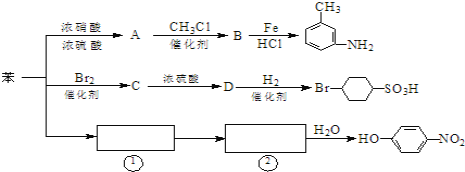
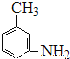
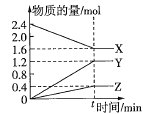
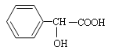
题目内容
【题目】![]() 时,分别向
时,分别向![]() 的氨水、醋酸铵溶液中滴加
的氨水、醋酸铵溶液中滴加![]() 的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是
的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是
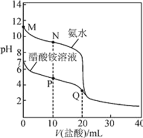
A.M点溶液中:![]()
B.N点溶液中:![]()
C.P点溶液中:![]()
D.Q点溶液中:![]()
【答案】D
【解析】
A. 一水合氨是弱电解质,电离程度较小,一水合氨电离导致溶液呈碱性,水还电离出氢氧根离子,则存在c(NH3H2O)>c(OH)>c(NH4+)>c(H+),故A错误;
B. N点溶液中溶质为等物质的量浓度的一水合氨、氯化铵,混合溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,但是其电离和水解程度都较小,则存在c(NH4+)>c(Cl)>c(NH3H2O)>c(OH),故B错误;
C. P点溶液中溶质为等物质的量浓度的氯化铵、醋酸铵和醋酸,溶液中存在物料守恒c(NH4+)+c(NH3H2O)=c(CH3COO)=2c(Cl),存在电荷守恒c(NH4+)+c(H+)=c(CH3COO)+c(Cl)+c(OH),溶液呈酸性,则c(H+)>c(OH),c(NH4+) <c(CH3COO)+c(Cl)①,由于 c(NH4+)+c(NH3H2O)= 2c(Cl)则0.5c(NH4+)+0.5c(NH3H2O) = c(Cl)②,将②代入①得到c(NH4+)<c(CH3COO)+0.5c(NH4+)+0.5c(NH3H2O),即0.5c(NH4+)<c(CH3COO)+0.5c(NH3H2O),左右两边同时乘以2所以得到c(NH4+)<2c(CH3COO)+c(NH3H2O),故C错误;
D. Q点溶质为等物质的量浓度的氯化铵和醋酸,溶液中存在物料守恒:c(Cl)=c(CH3COOH)+c(CH3COO)、c(Cl)=c(NH4+)+c(NH3H2O)、(CH3COOH)+c(CH3COO)=c(NH4+)+c(NH3H2O),所以存在2c(Cl)=c(CH3COOH)+c(NH4+)+c(CH3COO)+c(NH3H2O),则2c(Cl)〉c(CH3COOH)+c(NH4+),故D正确;
答案选D。

【题目】根据下列实验操作和现象能得出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 溶液红色褪去 |
|
B | 分别向盛有 | a中溶液变蓝,b中产生黄色沉淀 |
|
C | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热 | 未见有银镜产生 | 淀粉没有水解 |
D | 向无水乙醇中加入浓硫酸,加热,产生的气体通入酸性 | 溶液紫色褪去 | 气体中含有乙烯 |
A.AB.BC.CD.D