题目内容
【题目】在一密闭容器中发生反应N2+3H2![]() 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
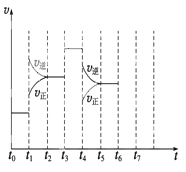
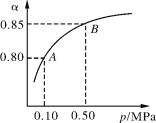
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
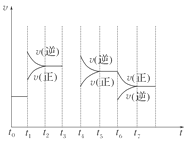
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
【答案】(1)ACDF
(2)C E B
(3)A
(4)
(5)5 ∶6
【解析】
(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v(正)、v(逆)相等,反应处于平衡状态。
(2)t1时,v(正)、v(逆)同时增大,且v(逆)增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v(正)、v(逆)同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v(正)、v(逆)同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最大。
(4)t6时刻分离出NH3,v(逆)马上减小,而v(正)逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线。
(5)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,则反应后气体总的物质的量=(a+b-2x)mol,=0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比===。