题目内容
【题目】回收利用硫和氮的氧化物是环境保护的重要举措。
(1)已知:2NO(g ) + O2(g)![]() 2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
第一步:2NO(g ) ![]() N2O2(g) △H1 =-a kJmolˉ1 (快反应)
N2O2(g) △H1 =-a kJmolˉ1 (快反应)
第二步:N2O2(g ) + O2(g)![]() 2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
①下列对上述反应过程表述正确的是__________(填标号)。
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为_______________。
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g)![]() 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
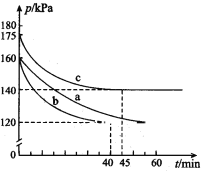
①与实验a相比,实验b改变的实验条件可能是______________________。
②实验b中的平衡转化率a(SO2)=_________。
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO![]() 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:

①曲线c对应NH3与NO 的物质的量之比是_______________。
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________ mg/(m3s)。
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
①用化学方程式表示NaOH 再生的原理____________________________________ 。
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为_____________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
【答案】BC (a+b+c)kJmolˉ1 使用催化剂 95% 1:1 1×10-4 CaO+H2O+Na2SO3 = CaSO3+ 2NaOH c(Na+)>c(HSO3-)=c(SO32-)>c(OH-)=c(H+)
【解析】
(1)①A.第一步正反应快,活化能小;
B.该化学反应的速率主要由最慢的一步决定;
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度不变反应达到平衡;
②已知:2NO(g)+O2(g)2NO2(g),正反应的活化能为ckJmol-1.该反应历程为:
第一步:2NO(g)N2O2(g)△H1=-akJmol-1(快反应)
第二步:N2O2(g)+O2(g)2NO2(g)△H2=-bkJmol-1(慢反应)
据此计算该反应逆反应的活化能=正反活化能-反应焓变;
(2)①a、c开始均通入2.8molCO和1mol SO2,容器的容积相同,而起始时c的压强大于a,物质的量与体积一定,压强与温度呈正比关系;
②结合三行计算列式得到,气体压强之比等于气体物质的量之比;
(3)①两种反应物存在的反应,增大一种反应物的量可提高另一种反应物的转化率,据此分析;
②根据NO的脱除量变化值和脱除时间计算NO的脱出速率;
(4)①过程中NaOH再生是平衡CaO(s)+H2O(l)═Ca(OH)2(s)Ca2+(aq)+2OH-(aq)正向进行;氢氧根离子浓度增大;
②25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、NaHSO3的混合溶液,且溶液恰好呈中性,已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7,可知SO32-的水解常数为![]() =1×10-7,可知Na2SO3的水解与NaHSO3的电离程度相等。
=1×10-7,可知Na2SO3的水解与NaHSO3的电离程度相等。
(1)①A.第一步正反应快,活化能小于第二步正反应活化能,故A错误;
B.第二步:N2O2(g)+O2(g)2NO2(g)△H2=-bkJmol-1(慢反应),该化学反应的速率主要由第二步决定,故B正确;
C.已知:2NO(g)+O2(g)2NO2(g),正反应的活化能为ckJmol-1.该反应历程为:
第一步:2NO(g)N2O2(g)△H1=-akJmol-1(快反应)
第二步:N2O2(g)+O2(g)2NO2(g)△H2=-bkJmol-1(慢反应)
分析过程可知,N2O2为该反应的中间产物,故C正确;
D.反应为可逆反应,在一定条件下N2O2的浓度不变时反应达到平衡,故D错误;
故答案为:BC;
②已知:2NO(g)+O2(g)2NO2(g),正反应的活化能为ckJmol-1.该反应历程为:
第一步:2NO(g)N2O2(g)△H1=-akJmol-1(快反应)
第二步:N2O2(g)+O2(g)2NO2(g)△H2=-bkJmol-1(慢反应)
逆反应的活化能为=正反活化能-反应焓变=c-[(-a)+(-b)] kJ /mol=(a+b+c)kJ /mol,
故答案为:(a+b+c)kJ /mol;
(2)①a、c开始均通入2.8molCO和1mol SO2,容器的容积相同,而起始时c的压强大于a,物质的量与体积一定,压强与温度呈正比关系,故c组改变的实验条件可能是:升高温度,
故答案为:升高温度;
②设消耗二氧化硫物质的量x,2CO(g) + 2SO2(g)![]() 2CO2(g) + S(l)
2CO2(g) + S(l)
变化量(mol) x x x
平衡量(mol)2.8-x 1-x x
![]() ,解得x=0.95mol,
,解得x=0.95mol,
实验b中的平衡转化率a(SO2)=![]() ×100%=95%,
×100%=95%,
故答案为:95%;
(3)①两种反应物存在的反应,增大一种反应物的量可提高另一种反应物的转化率,根据图象,曲线c的NO脱除率最低,即NO的转化率最低,所以NO的在总反应物中的比例最高,符合的是n(NH3):n(NO)的物质的量之比1:1,
故答案为:1:1;
②曲线a中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,根据图象,NO的脱除率从55%上升到75%,则该段时间内NO的脱除量为△c=4×10-4mg/m3×(75%-55%)=8×10-5mg/m3,时间间隔为△t=0.8s,所以该段时间内NO的脱除速率为=![]() = 1.0×10-4mg/(m3s),
= 1.0×10-4mg/(m3s),
故答案为:1.0×10-4;
(4)①过程中加入CaO,存在CaO(s)+H2O (l)═Ca(OH)2(s)Ca2+(aq)+2OH-(aq),因SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成,反应的化学方程式:CaO+H2O+Na2SO3═CaSO3+2NaOH,
故答案为:CaO+H2O+Na2SO3═CaSO3+2NaOH;
②已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7,可知SO32-的水解常数为![]() =
=![]() =1×10-7,可知Na2SO3的水解与NaHSO3的电离程度相等,则知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,即c(OH-)=c(H+),可知c(SO32-)=c(HSO3-),则溶液中存在c(Na+)>c(HSO3-)=c(SO32-)>c(OH-)=c(H+),
=1×10-7,可知Na2SO3的水解与NaHSO3的电离程度相等,则知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,即c(OH-)=c(H+),可知c(SO32-)=c(HSO3-),则溶液中存在c(Na+)>c(HSO3-)=c(SO32-)>c(OH-)=c(H+),
故答案为:c(Na+)>c(HSO3-)=c(SO32-)>c(OH-)=c(H+)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
序号 | 装置 | X溶液 | 现象 |
I |
| 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
II | Na2SO4 | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
III | H2SO4 | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |
A. 实验I中溶液红色褪去,说明发生了反应H+ + OH- =H2O
B. 实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH-
C. 实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O
D. 将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同