题目内容
【题目】过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于___区。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为___,该能层具有的原子轨道数为___,BH4-的空间构型是___。
(3)在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是___,乙醛分子中HCO的键角___乙醇分子中H-C-O的键角(填“大于”、“等于”或“小于”)。
(4)电镀厂排放的废水中常含有剧毒的CN-,可在TiO2的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为___。
②与CN-互为等电子体微粒的化学式为___(写出一种即可)。
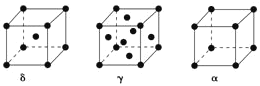
(5)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为___,δ、γ、α三种晶胞的边长之比为___。
【答案】d M 9 正四面体型 sp3、sp2 大于 H<C<N<O CO(或N2等) 4:6:3 ![]() :
:![]() :1
:1
【解析】
(1)Mn为第ⅤⅢ族元素,最后填充电子为d电子;
(2)基态Ti2+价电子排布式为:3d2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道;BH4-中B原子价层电子对=4+![]() (3+1-4×1)=4,且没有孤电子对;
(3+1-4×1)=4,且没有孤电子对;
(3)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式,碳原子杂化方式不同导致其键角不同;
(4)①非金属性越强,电负性越大;
②等电子体中原子数、价电子数相同;
(5)δ-Fe为体心立方密堆积,配位数为8,γ-Fe为面心立方密堆积,配位数为12,α=Fe为简单立方堆积,配位数为6;设原子半径为y,δ中体对角线为4r,γ中面对角线为4r、α中棱长为2r,以此计算。
![]() 为第ⅤⅢ族元素,外围电子排布式为
为第ⅤⅢ族元素,外围电子排布式为![]() ,最后填充电子为d电子,则位于d区,故答案为:d;
,最后填充电子为d电子,则位于d区,故答案为:d;
![]() 的原子序数为22,
的原子序数为22,![]() 核外有20个电子,
核外有20个电子,![]() 的电子排布式为
的电子排布式为![]() 或
或![]() ,基态
,基态![]() 价电子排布式为:
价电子排布式为:![]() ,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道,
,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道,![]() 中B原子价层电子对
中B原子价层电子对![]() ,且没有孤电子对,则为正四面体型;
,且没有孤电子对,则为正四面体型;
![]() 乙醛分子中甲基上碳原子含有4个
乙醛分子中甲基上碳原子含有4个![]() 键,醛基上的碳原子含有3个
键,醛基上的碳原子含有3个![]() 键,所以甲基中的碳原子采用
键,所以甲基中的碳原子采用![]() 杂化,醛基中的碳原子采用
杂化,醛基中的碳原子采用![]() 杂化,醛基中碳原子采用
杂化,醛基中碳原子采用![]() 杂化、乙醇中含有醇羟基的碳原子采用
杂化、乙醇中含有醇羟基的碳原子采用![]() 杂化,导致乙醛分子中
杂化,导致乙醛分子中![]() 的键角大于乙醇分子中的
的键角大于乙醇分子中的![]() 的键角;
的键角;
![]() 非金属性越强,电负性越大,则电负性为
非金属性越强,电负性越大,则电负性为![]() ;
;
![]() 与
与![]() 互为等电子体微粒的化学式为
互为等电子体微粒的化学式为![]() 或
或![]() 等
等![]() ;
;
![]() 为体心立方密堆积,配位数为8,
为体心立方密堆积,配位数为8,![]() 为面心立方密堆积,配位数为12,
为面心立方密堆积,配位数为12,![]() 为简单立方堆积,配位数为6,则
为简单立方堆积,配位数为6,则![]() 、
、![]() 、
、![]() 三种晶胞中铁原子的配位数之比为8:12:
三种晶胞中铁原子的配位数之比为8:12:![]() :6:3,设Fe的原子半径为r,
:6:3,设Fe的原子半径为r,![]() 、
、![]() 、
、![]() 晶胞的边长分别为
晶胞的边长分别为![]() 、
、![]() 、
、![]() ,则
,则![]() 中
中![]() ,
,![]() 中
中![]() ,
,![]() 中
中![]() ,则边长之比为:
,则边长之比为:![]() :
:![]() :
:![]() :
:![]() :1。
:1。