��Ŀ����
����Ŀ��Ӣ������˹�ش�ѧ��ѧ�Ұ����ҡ���ķ�Ϳ�˹̹����ŵ��Ф���ͬ��������Ķ�����ͻ���Եء���˺�ѵķ�����ʯī�гɹ���ó�������ʯīϩ�����Ʊ�ʯīϩ������ʯī���뷨����ѧ����������ȡ�ʯīϩ�����ģ��ʾ��ͼ���£�
��1�������й�ʯīϩ��˵����ȷ����_________
A.12gʯīϩ����ѧ����ΪNA
B.ʯīϩ����������ԭ�ӿ��Դ���ͬһƽ��
C.��ʯī�����ʯīϩ��˷�ʯī�����֮��ķ��Ӽ�������
D.ʯīϩ��ÿ��Cԭ������3����Ԫ��,ÿ����Ԫ��ռ��6��Cԭ��
��2����ѧ����������ǻ�ô���ʯīϩ����Ч����֮һ,����Ϊ��ͭ���ܵȽ�����Ͻ�,��̼Դ�����Ǽ��顢��Ȳ�������Ҵ���̪ݼ���е�һ�ֻ�������ϡ�
�ٻ�̬ͭԭ��������ߵĵ���ռ�ݵ��ܼ�������_________����������Ԫ����,������������ͭԭ����ͬ��Ԫ�ػ���___________��
�����з������ڷǼ��Է��ӵ���__________��
a.����b.���ȼ��� c.��d.�Ҵ�
���Ҵ��ķе�Ҫ������Է���������������Ķ���,�����ԭ��____________________________��
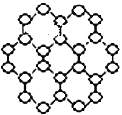
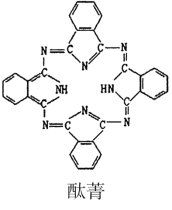
��̪ݼ��̪ݼͭȾ�Ϸ��ӽṹ����ͼ��,̪ݼ������̼ԭ�Ӳ��õ��ӻ���ʽ��____��
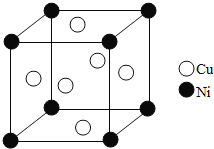
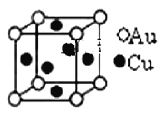
�ݽ���ͭ���γɵĽ���������Ͻ�(��ͼ),���Ļ�ѧʽ�ɱ�ʾΪ_________����Au��Χ�����������ȵ�Cu��_____��,��2��Cuԭ�Ӻ˵���С����Ϊd pm,�þ�����ܶȿ��Ա�ʾΪ__________g/cm3��(����٤��������NA��ʾ).
���𰸡�BC 3d K��Cr a��c �Ҵ����Ӽ���γ������������Ӽ䲻���γ���� sp2 Cu3Au��AuCu3 12 ![]()
��������
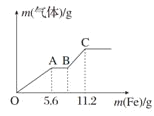
��1��A��ʯīϩ��һ��̼ԭ�Ӿ���1.5������������12gʯīϩ��������Ϊ1.5NA��ѡ��A����
B��̼̼˫��������ԭ�Ӷ�����ͬһƽ�棬���Ե���ʯīϩ����������ԭ�ӿ��Դ���ͬһƽ�棬ѡ��B��ȷ��
C��ʯī�ṹ�У�ʯī�����֮����ڷ��Ӽ������������Դ�ʯī�����ʯīϩ��˷�ʯī�����֮��ķ��Ӽ���������ѡ��C��ȷ��
D��ʯīϩ��������С�Ļ�Ϊ��Ԫ����ÿ��̼ԭ������3��C-C��ѧ������ÿ��Cԭ������3����Ԫ����ÿ����Ԫ��ռ�е�Cԭ����Ϊ6��![]() =2��ѡ��D����
=2��ѡ��D����
��ѡBC��
��2����ͭ��29��Ԫ�أ����̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p63s23p63d104s1����̬ͭԭ��������ߵĵ���ռ�ݵ��ܼ�������3d��
��������Ԫ����,������������ͭԭ����ͬ��Ԫ�ػ���K��Cr;
��a.����Ϊ��������ṹ���ṹ�Գƣ�������ɵ������غϣ����ڷǼ��Է��ӣ�ѡ��a��ȷ��
b.���ȼ���Ϊ��������ӣ��ṹ���Գƣ�������ɵ����IJ��غϣ����ڼ��Է��ӣ�ѡ��b����
c.��Ϊƽ���������Σ��ṹ�Գƣ�������ɵ������غϣ����ڷǼ��Է��ӣ�ѡ��c��ȷ��
d.�Ҵ��ṹ���Գƣ�������ɵ����IJ��غϣ����ڼ��Է��ӣ�ѡ��d����
��ѡac��
���Ҵ����Ӽ���������ʹ�����ۡ��е�����,��������Ӽ䲻���������
��̪ݼ������̼ԭ���γ�3��������1�����������Բ�ȡsp2�ӻ���̪ݼͭ���������ṩ�µ��ӶԵĵ�ԭ�Ӳ�����λԭ�ӣ�����̪ݼͭ��������ԭ�ӵ���λ��Ϊ2��
�ݸþ����к�ͭԭ�Ӹ���Ϊ6![]() =3�����н�ԭ����Ϊ8
=3�����н�ԭ����Ϊ8![]() =1,�����仯ѧʽΪCu3Au��AuCu3������ͼʾ��ͭԭ����Χ�����������ȵĽ�ԭ����4�������ݻ�ѧʽ����Au��Χ�����������ȵ�Cu��12������2��ͭԭ�Ӻ˵���С����Ϊd pm�������ⳤΪ
=1,�����仯ѧʽΪCu3Au��AuCu3������ͼʾ��ͭԭ����Χ�����������ȵĽ�ԭ����4�������ݻ�ѧʽ����Au��Χ�����������ȵ�Cu��12������2��ͭԭ�Ӻ˵���С����Ϊd pm�������ⳤΪ![]() d pm=
d pm=![]() d
d![]() 10-10 cm, �þ�����ܶ�=
10-10 cm, �þ�����ܶ�=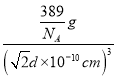 =
=![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������һЩԪ�ص���Ϣ��������һ��Ԫ�ز��ڶ����ڡ�
Ԫ��A | Ԫ��B | Ԫ��C | Ԫ��X | Ԫ��Y |
������һ�ֳ�����������Ԫ��X�γɺ�ɫ�ͺ���ɫ���ֳ��������� | ��̬ԭ��M��p�������5������ | �������н�������ǿ����X��Ӧ���������ֳ��������� | �������������ڲ��������3�������γ�˫ԭ�������� | ����Ϊ˫ԭ�ӷ��ӣ��ṹ������������Ŀ��Ϊ1:2 |
����������Ϣ�ش��������⣺
��1��д��X3�ĵȵ�����_____(дһ������)����̬Yԭ�Ӻ��������ռ�ݵ�����ܼ��ĵ�������״Ϊ______��
��2��AԪ����Ԫ�����ڱ��е�___������̬Aԭ�ӵ�δ�ɶԵ�����___����
��3��B��C��X�ļ����Ӱ뾶�ɴ�С��˳��Ϊ______�������ӷ��ţ���
��4��HX��HY���ֹ��ۼ��У����ļ��Խ�ǿ����____�������ϳ�����____��X��Y��Ԫ�ط��ű�ʾ����
��5��Y��̼Ԫ���γɵ�һ����������Y2�ǵȵ����壬��д���������ӵĵ���ʽ___��Y�ij����⻯��������ˮ����Ҫԭ����___��
��6����˿պȡ������CB�ھƾ��������գ������___ɫ����ɫԭ����___������ţ���
A��CB���Ȼӷ� B��CB���ȷֽ�
C��C�����е���ԾǨ D��B�����е���ԾǨ