题目内容
(7分)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)Z的氢化物(H2Z)与乙醇互溶,而H2Y在乙醇中溶解度较小,其原因是。
(2)Y与Z形成YZ42-的空间构型为。
(3)X与Y所形成化合物晶体的晶胞如图所示。
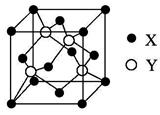
①在一个晶胞中,X离子的数目为;
②若该化合物的密度为ag·cm-3,则晶胞的体积是
cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
(1)Z的氢化物(H2Z)与乙醇互溶,而H2Y在乙醇中溶解度较小,其原因是。
(2)Y与Z形成YZ42-的空间构型为。
(3)X与Y所形成化合物晶体的晶胞如图所示。

①在一个晶胞中,X离子的数目为;
②若该化合物的密度为ag·cm-3,则晶胞的体积是
cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
(1)水分子与乙醇分子之间能形成氢键(2分)(2)正四面体(1分)
(3)①4(2分)②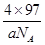 (
(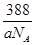 )(2分)
)(2分)
(3)①4(2分)②
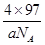 (
(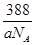 )(2分)
)(2分)试题分析:元素X位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,则
(1)在乙醇的水溶液中,水分子和乙醇分子之间易形成氢键,氢键的存在导致其溶解性增大,而H2S不能形成氢键。
(2)SO42-中价层电子数=4+
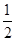 (6+2?4×2)=4,且没有孤电子对,所以是正四面体结构。
(6+2?4×2)=4,且没有孤电子对,所以是正四面体结构。(3)①X离子数目=8×
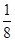 +6×
+6×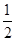 =4。
=4。②该晶胞中X离子数目=8×
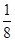 +6×
+6×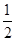 =4,Y离子数目=4,则1个晶胞的质量是
=4,Y离子数目=4,则1个晶胞的质量是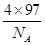 g,因此晶胞的体积是
g,因此晶胞的体积是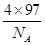 g÷ag·cm-3=
g÷ag·cm-3=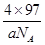 cm3。
cm3。
练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目


 。下列说法正确的是
。下列说法正确的是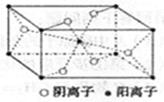
 键 G.
键 G. 键
键
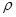 = g/cm3。(用含M、NA、b的计算式表示,不用化简)。
= g/cm3。(用含M、NA、b的计算式表示,不用化简)。