题目内容
下列说法正确的是( )
| A.原子半径大小:Na>S>O |
| B.金属性强弱:K>Na>Ca |
| C.酸性强弱:HIO4>HBrO4>HClO4 |
| D.碱性强弱:LiOH>NaOH>KOH |
A、同周期原子序数越大半径越小,则原子半径Na>S;不同周期电子层越多半径越大,则原子半径S>O,所以原子半径大小:Na>S>O,故A正确;
B、根据金属活动顺序表可知,金属的活泼性K>Ca>Na,金属越活泼则其金属性越强,所以金属性强弱:K>Ca>Na,故B错误;
C、非金属性越强,对应元素的最高价含氧酸的酸性越强,已知非金属性:Cl>Br>I,所以酸性强弱:HClO4>HBrO4>HIO4,故C错误;
D、金属性越强,对应元素的最高价氧化物的水化物的碱性越强,已知金属性:K>Na>Li,所以碱性强弱:KOH>NaOH>LiOH,故D错误.
故选A.
B、根据金属活动顺序表可知,金属的活泼性K>Ca>Na,金属越活泼则其金属性越强,所以金属性强弱:K>Ca>Na,故B错误;
C、非金属性越强,对应元素的最高价含氧酸的酸性越强,已知非金属性:Cl>Br>I,所以酸性强弱:HClO4>HBrO4>HIO4,故C错误;
D、金属性越强,对应元素的最高价氧化物的水化物的碱性越强,已知金属性:K>Na>Li,所以碱性强弱:KOH>NaOH>LiOH,故D错误.
故选A.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
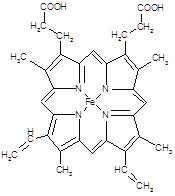
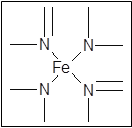
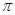 键有___________mol。
键有___________mol。