题目内容
下列变化中,必须加入还原剂才能发生的是
| A.FeCl2→FeCl3 | B.H2O→H2 | C.Al→NaAlO2 | D.CO2→C |
D
解析试题分析:加入还原剂发生还原反应,元素化合价降低。A、需加氧化剂,错误;B、需加氧化剂,错误;C、需加氧化剂,错误;D、需加还原剂,正确,答案选D。
考点:考查氧化还原反应中氧化剂、还原剂的应用

练习册系列答案
相关题目
下列说法中正确的是( )
| A.含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B.pH相等的NaOH、NaHCO3和Na2CO3三种溶液: c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C.常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a:b=2:9 |
下图是一种综合处理SO2废气的工艺流程。下列说法正确的是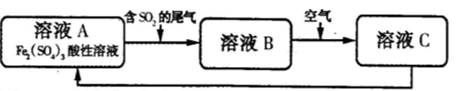
| A.向B溶液中滴加KSCN溶液,溶液变为血红色 |
| B.溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2=2Fe3++2H2O |
| C.溶液酸性A>B>C |
| D.加氧化亚铁可以使溶液C转化为溶液A |
已知NH4CuSO3与足量的2 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )
| A.反应中硫酸做氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.1 mol NH4CuSO3完全反应转移0.5 mol电子 |
| D.刺激性气味的气体是氨气 |
LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:
①2LiAlH4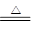 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑
②LiAlH4+2H2O=LiAlO2+4H2↑
下列说法正确的是( )
| A.LiAlH4是共价化合物,LiH是离子化合物 |
| B.生成等质量的氢气,反应①、②转移电子数之比为4?3 |
| C.氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑ |
| D.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 |
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为( )
| A.300 mL | B.400 mL | C.450 mL | D.500 mL |
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
\其中第①步中存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O。下列有关说法正确的是( )
Cr2O72—(橙色)+H2O。下列有关说法正确的是( )
| A.第①步当2v(Cr2O72—)=v(CrO42—)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42—的生成 |
| C.第②步中,还原0.1 mol Cr2O72—需要45.6 g FeSO4 |
| D.第③步沉淀剂a可以使用NaOH等碱性物质 |
LiNiO2是锂离子电池的正极活性材料,其制备原理可表示为4Ni(OH)2+4LiOH+O2=4LiNiO2+6H2O。下列说法正确的是( )
| A.LiNiO2中Ni的化合价是+1 | B.该反应中LiOH是还原剂 |
| C.OH-和Li+含有的电子数相同 | D.LiNiO2中既含离子键又含共价键 |
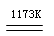 aTiCl4+cCO……反应①
aTiCl4+cCO……反应① Ti+2MgCl2……反应②
Ti+2MgCl2……反应②