题目内容
【题目】铝是一种应用广泛的金属。某兴趣小组对金属铝展开了系列研究。
I.研究铝的化学性质
(1)铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为______。实验前,需要对铝的表面先进行______(填操作)处理。兴趣小组同学将铝处理好后剪成若干大小相同的小片,用于后续实验。
(2)铝和酸、碱、盐溶液的反应
实验 | 操作 | 现象 | 结论 |
一 | 将铝片放入稀盐酸中 | ,试管变烫 | 铝能与盐酸发生反应,反应放热 |
二 | 将铝片放入氢氧化钠溶液中 | 铝表面有气泡产生试管变烫 | 铝能与氢氧化钠溶液反应,反应放热 |
三 | 将铝放入硫酸铜溶液中 | 铝表面有红色物质产生,溶液逐渐变成无色 | 金属活动性:铝 铜 |
实验一的现象为_____。
实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为____。实验三表明,铝的金属活动性____(填“大于“或”小于“)铜。
(3)小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内发现铝片表面产生的气泡较少,反应较慢。对比上述两组实验产生猜想。猜想①:稀盐酸中的氯离子对反应可能有促进作用。猜想②:____。为验证猜想①是否合理,应在铝和稀硫酸中加入____(填字母),观察现象。
A.Na2SO4 B.Na2CO3 C.NaCl
II.测定某铝样品中金属铝的质量分数
(资料1)氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
(资料2)AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl。
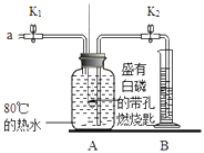
(4)小组同学称取4.62g某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加入足量稀盐酸至完全反应。将反应后的液体分成溶液1和溶液2两等份,设计两种实验方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。

①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程)。_____。
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积,计算后发现金属铝的质量分数偏大,可能的原因是_____。
【答案】4Al+3O2=2Al2O3 打磨 产生气泡 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 大于 稀硫酸中的硫酸根离子对反应可能有抑制作用 C 77.9% 反应放热,导致瓶内气体体积膨胀,排出的水偏多
【解析】
(1)铝和氧气在常温下反应生成氧化铝,方程式为4Al+3O2=2Al2O3,因此实验前,需要对铝的表面先进行打磨处理;
(2)铝的活泼性比较强,故实验一的现象为铝表面有气泡产生,铝和氢氧化钠、水反应生成偏铝酸钠和氢气,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,实验三铝能置换出铜,这说明铝的活泼性大于铜;
(3)两种溶液中阴离子不同,则猜想②:稀硫酸中的硫酸根离子对反应可能有抑制作用,为验证猜想①是否合理,应在铝和稀硫酸中加入NaCl,观察现象;
(4)①氢氧化钠过量不可能形成氢氧化铝沉淀,方案1不正确;整个样品中铝元素的质量![]() ,整个样品中氧化铝的质量
,整个样品中氧化铝的质量![]() ,整个样品种的铝的质量
,整个样品种的铝的质量![]() ,样品中金属铝的质量分数
,样品中金属铝的质量分数![]() ;
;
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积,计算后发现金属铝的质量分数偏大,可能的原因是反应放热,导致瓶内气体体积膨胀,排出的水偏多。

【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO3- >I2 |
B | 淀粉溶液在硫酸存在下加热一段时间后,再与新制的Cu(OH)2悬浊液混合,加热煮沸 | 无红色沉淀生成 | 淀粉没有水解 |
C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数:Kh(CH3COO-)<Kh(HCO3-) |
D | 常温时,用两支试管各取5 mL 0.1 mol/L 酸性KMnO4溶液,分别加入0.1 mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2 mol/L H2C2O4溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
A. A B. B C. C D. D