题目内容
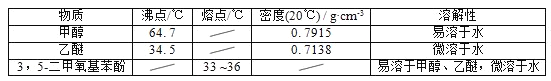
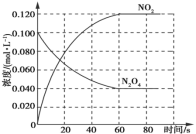
【题目】在容积为1 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。
2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。
下列说法错误的是( )
A.0~60 s时段内,平均反应速率v(NO2)=0.002 0 mol·L-1·s-1
B.60 s后,体系温度保持100 ℃,则混合气体的平均相对分子质量保持不变
C.T ℃>100 ℃,第100 s时,c(N2O4)=0.020 mol·L-1
D.100 s后,在T ℃将容器体积缩小为0.5 L,则正反应速率减小,逆反应速率增大
【答案】D
【解析】
A. 根据图像0~60 s时段,NO2的物质的量浓度变化为0.120 mol·L-1,根据公式v=![]() =
= ![]() =0.002 0 mol·L-1·s-1,故A正确;
=0.002 0 mol·L-1·s-1,故A正确;
B. 60 s后,体系温度保持100 ℃,由图可知,NO2和N2O4的浓度不在变化,说明反应达到平衡状态,混合气体的平均相对分子质量保持不变,故B正确;
C.将体系温度改为T ℃,10s后达到平衡,平衡时c(N2O4)=0.04mol L-1-0.002 mol L-1 s-1×10s=0.020 mol·L-1,故C正确;
D. 温度T时反应达到平衡后,将反应容器的容积减小一半,压强增大,平衡会向气体体积减小的方向移动,该反应逆反应为气体体积减小的反应,故平衡向逆反应方向移动。同时正逆反应速率都增大,故D错误;
题目要求选择错误的,故选D。

 名校课堂系列答案
名校课堂系列答案【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)