题目内容
18.下列有关工业生产的叙述正确的是( )| A. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 炼铁是铁矿石在高温下被氧化的过程 | |
| D. | 钴的制备:3Co3O4+8Al$\stackrel{高温}{→}$9Co+4Al2O3 |
分析 A.根据外界条件改变,对化学反应速率的影响和对化学平衡的影响角度进行解答;
B.接触室安装热交换器是为了利用SO2与O2反应放出的热量;
C.化合价降低被还原;
D.钴的制备是用铝热反应.
解答 解:A.根据升温、加压、增大浓度、使用催化剂等可加快化学反应速率,反之减慢.对于可逆反应来说,正逆反应速率的变化趋势是一样的,合成氨生产过程中将NH3液化分离,减少了生成物的浓度,所以减慢正逆反应速率,但平衡向正反应方向移动,提高了N2、H2的转化率,故A错误;
B.硫酸工业中,在接触室安装热交换器是为了利用SO2与O2反应放出的热量,对SO2与O2反应进行预热,SO3转化为H2SO4是在吸收塔中进行的,故B错误;
C.炼铁是铁矿石中的主要成分三氧化二铁在高温下被还原剂一氧化碳还原为单质铁的过程,故C错误;
D.钴的制备是用铝热反应,反应方程式为:3Co3O4+8Al$\stackrel{高温}{→}$9Co+4Al2O3,故D正确;
故选D.
点评 本题考查化学平衡的影响因素、氯碱工业、硅酸盐等知识,对于与实际生产、生活相关的化学知识,注意收集、积累.

练习册系列答案
相关题目
6.已知25℃时,醋酸、碳酸、次氯酸、氢氟酸和亚硫酸的电离平衡常数分别为
(1)写出H2SO3的电离方程式H2SO3?H++HSO3-,HSO3-?H++SO32-.
(2)在25℃时,相同物质量浓度、相同体积的上述五种酸溶液中,氢离子浓度最大的是H2SO3(填“醋酸”、“碳酸”、“次氯酸”、“氢氟酸”或“亚硫酸”,下同);水电离的氢离子浓度最大的是HClO.
(3)在25℃时,0.1mol•L-1的氢氟酸的电离度=6%;溶液pH的测定可用广泛pH试纸,其操作方法是:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有HF溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较,确定溶液的pH;加水稀释该氢氟酸溶液,下列数值增大的是BD.
A.c(F-) B.c(OH-) C.c(H+)•c(OH-) D.c(F-)/c(HF) E.c(F-)/c(HF)•c(OH-)
(4)下列离子方程式中正确的是AC.
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-═HCO3-+HClO
B.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO
C.过量SO2通入碳酸钠溶液中:2SO2+H2O+CO32-═2HSO3-+CO2
D.过量CH3COOH加入碳酸钠溶液中:CH3COOH+CO32-═CH3COO-+HCO3-
(5)若反应反应:Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增加,可以加入E.
A.Na2SO3 B.H2O C.Na2CO3D.NH3•H2OE.NaHCO3
(6)常温下,0.1mol/L醋酸溶液与0.01mol/L醋酸溶液中的c(H+)分别为A与B,则两者的c(H+)大小关系为:A小于10B.(填“大于”、“等于”、“小于”)
| 弱电解质 | CH3COOH | HClO | HF | H2CO3 | H2SO3 |
| 电离平衡常数 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka=3.6×10-4 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.5×10-2 Ka2=1.0×10-7 |
(2)在25℃时,相同物质量浓度、相同体积的上述五种酸溶液中,氢离子浓度最大的是H2SO3(填“醋酸”、“碳酸”、“次氯酸”、“氢氟酸”或“亚硫酸”,下同);水电离的氢离子浓度最大的是HClO.
(3)在25℃时,0.1mol•L-1的氢氟酸的电离度=6%;溶液pH的测定可用广泛pH试纸,其操作方法是:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有HF溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较,确定溶液的pH;加水稀释该氢氟酸溶液,下列数值增大的是BD.
A.c(F-) B.c(OH-) C.c(H+)•c(OH-) D.c(F-)/c(HF) E.c(F-)/c(HF)•c(OH-)
(4)下列离子方程式中正确的是AC.
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-═HCO3-+HClO
B.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO
C.过量SO2通入碳酸钠溶液中:2SO2+H2O+CO32-═2HSO3-+CO2
D.过量CH3COOH加入碳酸钠溶液中:CH3COOH+CO32-═CH3COO-+HCO3-
(5)若反应反应:Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增加,可以加入E.
A.Na2SO3 B.H2O C.Na2CO3D.NH3•H2OE.NaHCO3
(6)常温下,0.1mol/L醋酸溶液与0.01mol/L醋酸溶液中的c(H+)分别为A与B,则两者的c(H+)大小关系为:A小于10B.(填“大于”、“等于”、“小于”)
13.下列物质能够导电的是( )
| A. | 熔融的氢氧化钠 | B. | 硝酸钾溶液 | C. | 硫酸铜晶体 | D. | 无水乙醇 |
10.下列说法不正确的是( )
| A. | 由反应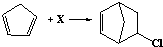 可知,X为氯乙烯 可知,X为氯乙烯 | |
| B. | 异辛烷的结构为(CH3)3CCH2CH(CH3)2,它的一氯代物共有4种同分异构体(不考虑对映异构体),且它们的熔点、沸点各不相同 | |
| C. | 已知CHCl3+HF→CHFCl2+HCl,此反应与由苯制备溴苯的反应类型相同 | |
| D. | 棉、毛、丝、麻完全燃烧时,都只生成CO2和H2O |
7.某同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A. | 所用NaOH已经潮解 | |
| B. | 向容量瓶中加水定容时俯视标线 | |
| C. | 用量筒量取所需的浓盐酸时俯视刻度线 | |
| D. | 定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水 |
8.工业刻制印刷电路的主要原理为:Cu+2FeCl3=2FeCl2+CuCl2.有关该反应的说法正确的是( )
| A. | Cu是氧化剂 | B. | FeCl3是还原剂 | ||
| C. | Cu在反应中失去电子 | D. | FeCl3发生氧化反应 |


 ,反应④的反应类型是消去反应.
,反应④的反应类型是消去反应.