题目内容
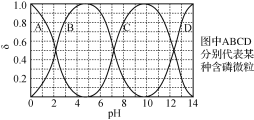
【题目】下列图示与对应的叙述相符的是

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率等于b点
D. 图4表示同一温度下,相同物质的量BaO2在不同容积的容器中进行反应:2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
【答案】B
【解析】
A、醋酸是弱酸溶液中存在电离平衡,加水稀释促进电离,加水稀释10n倍,促进醋酸的电离,溶液的pH变化小于n个单位;
B、图象分析可知,T2温度下,氢离子浓度和氢氧根离子浓度乘积小于T1温度下氢离子浓度和氢氧根离子浓度乘积,水的电离是吸热过程,温度越高水电离程度越大,氢离子和氢氧根离子浓度乘积越大;
C、图象分析可知,随氢气体积分数增大,平衡正向进行氨气平衡体积分数增大,但随氢气量的增大超过平衡移动量的增大,氨气的体积分数会减小,但增大氢气的浓度,氮气转化率增大;
D、同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),体积越大压强越小,则平衡正向进行,氧气浓度增大,最终与原浓度,相同温度下平衡常数不变,此反应的平衡常数K=c(O2)。
2BaO(s)+O2(g),体积越大压强越小,则平衡正向进行,氧气浓度增大,最终与原浓度,相同温度下平衡常数不变,此反应的平衡常数K=c(O2)。
A.加水稀释10n倍,促进醋酸的电离,溶液的pH变化小于n个单位,所以1 LpH=2的CH3COOH溶液加水稀释至V L,pH变化小于lgV,故A错误;
B.升温促进水电离,Kw增大,水电离的氢离子浓度增大,所以氢离子浓度大的温度高,即温度T2<T1,故B正确;
C.增大氢气的浓度,提高氮气的转化率,所以随H2起始体积分数增大,N2的转化率增大,即a点N2的转化率小于b点,故C错误;
D.增大容器的体积,氧气的浓度减小,平衡向正方向移动,氧气的物质的量增大,氧气的浓度先增大,当达到平衡状态时浓度增大,然后随着体积的增大浓度减小,温度不变,平衡常数不变,K=c(O2),最终氧气平衡浓度不变,则图象不符,故D错误。
故选:B。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
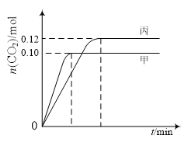
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%