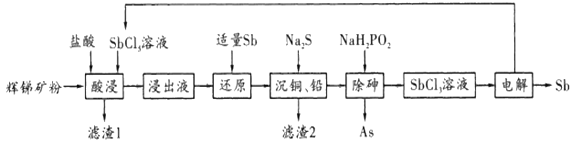
题目内容
【题目】磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾的流程如下:
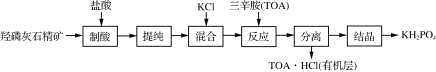
(1)“制酸”过程中生成磷酸的化学方程式为___________________________________________________。
该过程若用硫酸代替盐酸,磷酸的产率明显降低,其原因是___________________________________。
(2)“反应”中加入有机碱——三辛胺(TOA)的目的是____________________________________________。
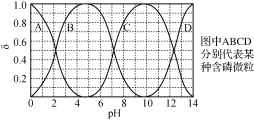
(3)“反应”中,三辛胺的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ随pH的变化如右图所示。
①“反应”中,当pH=____时,停止加入三辛胺。
②使用pH试纸测定溶液pH的操作是_____________________________________________。
(4)查阅资料可知:①磷酸三丁酯、二(2乙基己基)磷酸都是难溶于水的液态有机物。
②磷酸三丁酯对H3PO4和Fe3+有较强的萃取作用。
③二(2乙基己基)磷酸仅对Fe3+有较强的萃取作用。
请根据题中信息,补充完整“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭,________________,向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。[实验中须使用的试剂有:二(2乙基己基)磷酸、磷酸三丁酯]
【答案】Ca5(PO4)3OH+10HCl===5CaCl2+3H3PO4+H2O 使用H2SO4,会产生微溶性的CaSO4覆盖在羟磷灰石的表面,阻止反应的继续进行 加入三辛胺会与溶液中的HCl反应,促进了KH2PO4生成 4.5 用洁净的玻璃棒蘸取溶液滴在pH试纸上,立即与标准比色卡对比,读取pH 过滤,向滤液中加入适量二(2乙基己基)磷酸,振荡、静置,分液取水层;在水层中加入适量磷酸三丁酯,振荡,静置,分液取有机层
【解析】
(1)“制酸”过程中羟磷灰石精矿与盐酸反应生成磷酸、氯化钙和水,反应的化学方程式为Ca5(PO4)3OH+10HCl=5CaCl2+3H3PO4+H2O;
该过程若用硫酸代替盐酸,会产生微溶性的CaSO4覆盖在羟磷灰石的表面,阻止反应的继续进行,使磷酸的产率明显降低;
(2)“反应”中加入有机碱——三辛胺(TOA)会与溶液中的HCl反应,促进了KH2PO4生成;
(3)①“反应”中,三辛胺的用量会影响溶液的pH。三辛胺(TOA)会与溶液中的HCl反应,促进了KH2PO4生成,当pH=4.5时,c(H2PO4-)最大,故“反应”中,当pH=4.5时,停止加入三辛胺;
②使用pH试纸测定溶液pH的操作是用洁净的玻璃棒蘸取溶液滴在pH试纸上,立即与标准比色卡对比,读取pH;
(4)“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭,过滤,向滤液中加入适量二(2乙基己基)磷酸,振荡、静置,分液取水层;在水层中加入适量磷酸三丁酯,振荡,静置,分液取有机层,向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案