题目内容
9. 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | 图中x点的坐标为(100,6) | |
| C. | 若升高温度,图象会发生变化 | |
| D. | 把0.1mol•L-1的NaCl换成0.1mol•L-1 NaI则图象在终点后变为虚线部分 |
分析 A、根据pAg=-lg{c(Ag+)}求出Ag+的浓度;
B、x点c(Ag+)=10-6 mol•L-1,根据硝酸银的量求出消耗的氯化钠;
C、温度改变,物质的溶解度改变;
D、由于Ksp(AgI)更小,所以c(Ag+)更小.
解答 解:A、图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 mol•L-1,即原AgNO3溶液的物质的量浓度为1 mol•L-1,故A正确;
B、x点c(Ag+)=10-6 mol•L-1,一般认为溶液中离子浓度小于10-5 mol•L-1,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol•L-1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故B正确;
C、温度改变,AgCl物质的溶解度改变,图象也改变,故C正确;
D、与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol•L-1的NaCl换成0.1mol•L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误;
故选D.
点评 本题考查了AgCl的Ksp的应用,注意把握题干中的信息,考查学生分析题目信息并用于解决问题的能力,题目难度中等.

练习册系列答案
相关题目
19.用惰性电极电解下列溶液一段时间后,再加入一定量的某种物质(括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
| A. | AgNO3(AgNO3) | B. | NaOH(NaOH) | C. | KCl(KCl) | D. | CuSO4(CuO) |
10.在100mL混合液中,HNO3和H2SO4物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1.92gCu粉,加热充分反应后,所得气体在标况下的体积约为( )
| A. | 0.336L | B. | 0.448L | C. | 0.896 L | D. | 1.344L |
8.在下列元素中,原子半径最小的是( )
| A. | Na | B. | S | C. | O | D. | F |
 以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题:
以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题: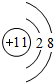 ,BD4的电子式为
,BD4的电子式为 .
.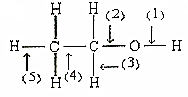 根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.
根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.
 “有钱就是这么任性”是2014年流行起来的网络用语.用来调侃有钱人令网友大跌眼镜的做事风格.甲、乙两种有机物分子的键线式如图,很像“任性”的汉语拼音缩写.
“有钱就是这么任性”是2014年流行起来的网络用语.用来调侃有钱人令网友大跌眼镜的做事风格.甲、乙两种有机物分子的键线式如图,很像“任性”的汉语拼音缩写.