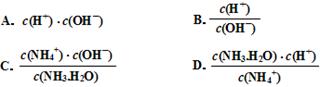题目内容
下列叙述正确的是
| A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| B.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl) |
| C.25℃时,pH=4,浓度均为0.1mol·L—1的CH3COOH、CH3COONa混合溶液: c(CH3COO—)+c(OH—)>c(CH3COOH)+c(H+) |
| D.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: c(Na+)=c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
AC
A正确,符合电荷守恒;硫酸氢铵电离出氢离子,抑制NH4+水解,所以在c(NH4+)相等的条件下,c(NH4Cl)>c(NH4HSO4) > c[(NH4)2SO4],B不正确;C中pH=4,说明醋酸的电离程度大于醋酸钠的水解程度,所以c(Na+)>c(CH3COOH),所以根据电荷守恒定律可知,C正确;D中如果恰好反应,则生成硫酸钠和硫酸铵,溶液显酸性,所以要满足显中性,则氢氧化钠是过量的,所以应该是 c(NH4+)>c(Na+)=c(SO42-)>c(OH-)=c(H+),D不正确,答案选AC。

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目