题目内容
(6分)已知在0.1mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为:[Na+]>[HSO3-]>[SO32-]>[H2SO3]。则:
(1)则该溶液中[H+]____[OH-](填“<”“>”“=”),简述理由(用离子方程式表示)____。
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的氢氧化钠溶液,可观察到的现象是_____________________;写出该反应的离子方程式_________________。
(1)则该溶液中[H+]____[OH-](填“<”“>”“=”),简述理由(用离子方程式表示)____。
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的氢氧化钠溶液,可观察到的现象是_____________________;写出该反应的离子方程式_________________。
(1)>。在亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-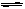 H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O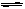 H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
(2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
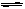 H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O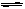 H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。(2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
(1)在亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-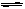 H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O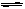 H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,因此溶液显酸性,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,因此溶液显酸性,所以可确定[H+]>[OH-]。
(2)HSO3-结合OH-的能力大于NH4+结合OH-能力,所以当氢氧化钠少量时,HSO3-和氢氧化钠反应,NH4+不反应,所以现象是含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
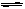 H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O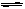 H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,因此溶液显酸性,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,因此溶液显酸性,所以可确定[H+]>[OH-]。(2)HSO3-结合OH-的能力大于NH4+结合OH-能力,所以当氢氧化钠少量时,HSO3-和氢氧化钠反应,NH4+不反应,所以现象是含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。

练习册系列答案
相关题目