题目内容
【题目】汽车尾气中通常含有NxOy和CO等大气污染物,科学家寻找高效催化剂实现了汽车尾气的转化进而减少汽车尾气对大气的污染。
(1)己知:①CO的燃烧热△H1=-283kJ·mol-1 ②N2(g)+O2(g) =2NO(g) △H2 =+183kJ·mol-1
由此写出NO和CO反应的热化学反应方程式________________________________。
(2)一定温度下,向2L密闭容器中充入4.0mo1NO2和4.0molCO,在催化剂作用下发生反应 4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
0 min | 5 min | 10 min | 15 min | 20 min | |
c(NO2)/ mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
C(N2)/ mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①5l0min,用N2的浓度变化表示的反应速率为__________________。
②以下表述能说明该反应己达到平衡状态的是________。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向容器中加入1.0mol NO2和1.0molCO,在t1时刻反应再次达到平衡,则NO2的转化率比原平衡 ______________(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= __________ (保留两位有效数字)。
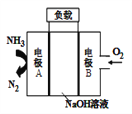
(3)CO、空气与过量KOH溶液可构成燃料电池(石墨为电极):
①写出该电池的负极反应式____________________________;
②常温下,用该燃料电池电解(惰性电极)1L饱和食盐水(足量),当两极共生成4.48L (折算为标准状况)气体时电解池溶液的pH=__________。(忽略溶液的体积变化,己知1g2=0.3,lg5=0.7)
【答案】 2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H=-749 kJ·moL-1 0.014 mol·L-1·min-1 A、C 增大 0.11 CO-2e-+4OH-=CO32-+2H2O 13.3
N2(g)+2CO2(g) △H=-749 kJ·moL-1 0.014 mol·L-1·min-1 A、C 增大 0.11 CO-2e-+4OH-=CO32-+2H2O 13.3
【解析】(1)己知:CO的燃烧热△H1=-283kJ·mol-1,则
①2CO(g)+O2(g)![]() 2CO2(g)△H1=-566kJ·moL-1
2CO2(g)△H1=-566kJ·moL-1
②N2(g)+O2(g)=2NO(g)△H2=+183kJ·mol-1
根据盖斯定律可知①-②即得到NO和CO反应的热化学反应方程式为2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=-749 kJ·moL-1。
N2(g)+2CO2(g)△H=-749 kJ·moL-1。
(2)①根据表中数据可知5l0min内氮气浓度的变化量为0.22mol/L-0.15mol/L=0.07mol/L,因此用N2的浓度变化表示的反应速率为0.07mol/L÷5min=0.014 mol·L-1·min-1。②A.气体颜色不再变化说明NO2浓度不再发生变化,反应达到平衡状态,A正确;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此气体密度不再变化不能说明反应达到平衡状态,B错误;C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以气体平均相对分子质量不再变化说明反应达到平衡状态,C正确,答案选AC;③20 min时,保持温度不变,继续向容器中加入1.0mol NO2和1.0molCO,相当于增大压强,在t1时刻反应再次达到平衡,则NO2的转化率比原平衡增大。④根据方程式可知
4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g)
N2(g)+4CO2(g)
起始浓度(mol/L) 2 2 0 0
转化浓度(mol/L) 1 0.5 0.25 1
平衡浓度(mol/L) 1 1.5 0.25 1
所以该温度下反应的化学平衡常数K=![]() 。
。
(3)①CO在负极通入,发生失去电子的氧化反应,电解质溶液是KOH,所以该电池的负极反应式为CO-2e-+4OH-=CO32-+2H2O;②气体的物质的量是0.2mol,因此氢气和氯气均是0.1mol,则生成氢氧化钠是0.2mol,浓度是0.2mol/L,所以氢离子浓度是![]() ,则电解池溶液的pH=14-lg5=13.3。
,则电解池溶液的pH=14-lg5=13.3。