题目内容
【题目】实验室欲用NaOH固体配制1.0mol·L-1 的NaOH溶液 240mL
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移⑥洗涤 ⑦定容 ⑧冷却
本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有_________.
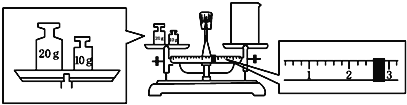
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为__________g,要完成本实验该同学应称出__________gNaOH.
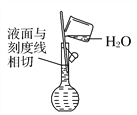
(3)使用容量瓶前必须进行的一步操作是_________________________________.
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________________.
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
【答案】 250mL容量瓶 27.4 10.0 查漏 ④⑤
【解析】(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,用到的仪器依次为:托盘天平、药匙、玻璃棒、烧杯、容量瓶和胶头滴管,要配制1.0molL-1的NaOH溶液240mL,应选择250mL容量瓶,所以还缺少的仪器:250mL容量瓶;故答案为:250mL容量瓶;
(2)依据天平称量固体原理结合图像可知:砝码的质量=烧杯质量 +游码的质量,左盘中砝码为20g,10g,游码质量2.6g,所以烧杯的实际质量为20g+10g-2.6g=27.4g;配制1.0molL-1的NaOH溶液240mL,应选择250mL容量瓶,配制250mL溶液,需要氢氧化钠质量m=1.0mol/L×40g/mol×0.25L=10.0g;故答案为:27.4;10.0;
(3)容量瓶带有活塞,使用过程中需要上下颠倒,所以使用前应检查是否漏水,故答案为:查漏;
(4)①没有洗涤烧杯和玻璃棒,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;②转移溶液时不慎有少量洒到容量瓶外面,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;④定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选;⑤未冷却到室温就将溶液转移到容量瓶并定容,冷却后,液面下降,溶液体积偏小,溶液浓度偏高,故选;⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;故答案为:④⑤。

 名校课堂系列答案
名校课堂系列答案【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:

请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖