题目内容
【题目】(1)配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水(______)
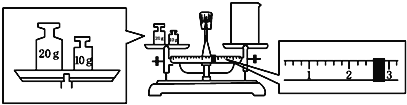
(2)称取2.0 g NaOH固体,可先在托盘上各放一张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体(_______)
(3)按照下图操作,配制一定浓度的NaCl溶液(_____)

(4)按照下图操作,配制0.10 mol·L-1 NaOH溶液(______)
(5)配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高(_______)
(6)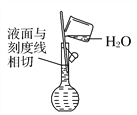 配制溶液(_______)
配制溶液(_______)
(7)因为Ca(OH)2能制成澄清石灰水,所以可配制2.0 mol·L-1的Ca(OH)2溶液(_____)
(8)配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流(_______)
(9)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小(________)
(10)用固体NaCl配制0.5 mol·L-1的溶液,所用的仪器有:烧杯、玻璃棒、胶头滴管、容量瓶(_______)
【答案】 错 错 错 错 对 错 错 对 错 错
【解析】(1)配制稀硫酸时,应先倒入蒸馏水,然后将浓硫酸沿器壁注入烧杯中,故(×);
(2)因NaOH易潮解,称量时应NaOH放在烧杯中称量,故(×);
(3)配制一定浓度的NaCl溶液,定容进视线应与液面的最低处水平,故(×);
(4)NaOH应在烧杯中溶解、冷却后转移到容量瓶中,故(×);
(5)配制溶液定容时,俯视容量瓶刻度,溶液的体积偏小,会使溶液浓度偏高,故(√);
(6)定容时液面的最低处与刻度线相切,故(×);
(7)Ca(OH)2只能微溶于水,无法配制2.0 mol·L-1的Ca(OH)2溶液,故(×);
(8)溶液配制时,转移液体需要玻璃棒引流,故(√);
(9))配制溶液定容时,俯视容量瓶刻度,溶液的体积偏小,会使溶液浓度偏高,故(×;
(10)用固体NaCl配制溶液,需要用到托盘天平称量固体,缺少托盘天平,故(×)。

 阅读快车系列答案
阅读快车系列答案