题目内容
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
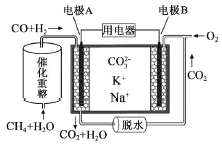
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3

(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品,B装置的名称是______________
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为_____________。
【答案】 BD ![]() 平衡压强 饱和食盐水 防止NaClO分解为NaCl和NaClO3影响水合肼的产率
平衡压强 饱和食盐水 防止NaClO分解为NaCl和NaClO3影响水合肼的产率 ![]() 冷凝管 淀粉溶液 25%
冷凝管 淀粉溶液 25%
【解析】(1)考查溶液的配制,配制一定质量分数的溶液,需要的仪器有烧杯、玻璃棒、天平、量筒,因此缺少的玻璃仪器有烧杯和玻璃棒;(2)本题考查氧化还原反应方程式的书写和物质除杂等知识,装置I是制取Cl2,离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2HO;II中玻璃管作用是平衡压强;产生的Cl2中混有HCl,HCl和NaOH反应生成NaCl,使NaClO含有杂质增多,因此必须除去HCl,常通过饱和食盐水;根据信息,温度过高,生成的NaClO分解成NaCl和NaClO3,,因此控制温度防止转化生成NaClO3,防止影响水合肼的产率;(3)NaClO具有强氧化性,把N2H4的氮氧化成N2,本身被还原成Cl-,因此有NaClO+N2H4·H2O→N2↑+NaCl+H2O,Cl的化合价降低2价,N的化合价共升高4价,最小公倍数为4,根据原子守恒,配平其他,即2NaClO+N2H4·H2O=N2↑+2NaCl+3H2O;B装置的名称为冷凝管;(4)本题考查滴定实验,①因为有I2参与反应,即指示剂为淀粉,淀粉遇碘单质变蓝;②根据反应方程式,n(N2H4·H2O)=n(I2)/2=20×10-3×0.15/2mol=1.5×10-3mol,其质量为1.5×10-3×50g=0.075g,质量分数为0.075/0.3×100%=25%。
Mn2++Cl2↑+2HO;II中玻璃管作用是平衡压强;产生的Cl2中混有HCl,HCl和NaOH反应生成NaCl,使NaClO含有杂质增多,因此必须除去HCl,常通过饱和食盐水;根据信息,温度过高,生成的NaClO分解成NaCl和NaClO3,,因此控制温度防止转化生成NaClO3,防止影响水合肼的产率;(3)NaClO具有强氧化性,把N2H4的氮氧化成N2,本身被还原成Cl-,因此有NaClO+N2H4·H2O→N2↑+NaCl+H2O,Cl的化合价降低2价,N的化合价共升高4价,最小公倍数为4,根据原子守恒,配平其他,即2NaClO+N2H4·H2O=N2↑+2NaCl+3H2O;B装置的名称为冷凝管;(4)本题考查滴定实验,①因为有I2参与反应,即指示剂为淀粉,淀粉遇碘单质变蓝;②根据反应方程式,n(N2H4·H2O)=n(I2)/2=20×10-3×0.15/2mol=1.5×10-3mol,其质量为1.5×10-3×50g=0.075g,质量分数为0.075/0.3×100%=25%。

 阅读快车系列答案
阅读快车系列答案【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)以便固体溶解。该步反应的离子方程式为 (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是 ;使用萃取剂适宜的pH=____(填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)= 。