题目内容
8.固体X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如图框图的转化关系,有的反应标出全部产物,有的反应标出部分产物.已知P为两种气体的混合物,R是无色无味能使澄清石灰水变浑浊的气体,C为红褐色物质,M为常见金属单质,Q为常见非金属单质.试填空.
(1)R的电子式
 X的化学式为Fe3C,P中气体的化学式为CO2、NO2.
X的化学式为Fe3C,P中气体的化学式为CO2、NO2.(2)实现G→H,欲不引进新的杂质,N可以选择下列物质中的③④(填序号).
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出B和M反应的化学方程式:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(4)已知P中有一种气体与氢氧化钠溶液反应可生成两种正盐,该反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O.
分析 根据题各物质转化关系,R是无色无昧且能使澄清石灰水变浑浊的气体,判断为CO2,则F应为碳酸盐,则P中应含有碳元素,C为红褐色沉淀为Fe(OH)3,则A和H中都含有铁离子,所以A为Fe(NO3)3,固体X是由两种常见元素组成的化合物,判断一定含有铁元素和碳元素,其中金属元素与另一元素的质量比为14:1.则X化学式为Fe3C,根据元素守恒,B中应含有氢元素,则依据M为常见金属单质,与B反应生成Q和D,Q为常见非金属单质,所以B为H2O,Q为H2,H含有铁元素判断,M为金属Fe,D为Fe3O4,D与盐酸反应生成G为FeCl2和FeCl3,N为Cl2,G与N反应生成H为FeCl3,C加热生成E为Fe2O3,X与浓硝酸反应生成混合气体P应为CO2、NO2,据此答题.
解答 解:根据题各物质转化关系,R是无色无昧且能使澄清石灰水变浑浊的气体,判断为CO2,则F应为碳酸盐,则P中应含有碳元素,C为红褐色沉淀为Fe(OH)3,则A和H中都含有铁离子,所以A为Fe(NO3)3,固体X是由两种常见元素组成的化合物,判断一定含有铁元素和碳元素,其中金属元素与另一元素的质量比为14:1.则X化学式为Fe3C,根据元素守恒,B中应含有氢元素,则依据M为常见金属单质,与B反应生成Q和D,Q为常见非金属单质,所以B为H2O,Q为H2,H含有铁元素判断,M为金属Fe,D为Fe3O4,D与盐酸反应生成G为FeCl2和FeCl3,N为Cl2,G与N反应生成H为FeCl3,C加热生成E为Fe2O3,X与浓硝酸反应生成混合气体P应为CO2、NO2,
(1)根据上面的分析可知,R为CO2,其电子式为 ,X的化学式为Fe3C,P为CO2、NO2,
,X的化学式为Fe3C,P为CO2、NO2,
故答案为: ;Fe3C;CO2、NO2;
;Fe3C;CO2、NO2;
(2)实现FeCl2→FeCl3,欲不引进新的杂质,N可以用H2O2或Cl2,故选③④;
(3)M为金属Fe,水和铁在高温反应的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(4)P为CO2、NO2,P中有一种气体与氢氧化钠溶液反应可生成两种正盐,则该反应为二氧化氮与氢氧化钠反应生成硝酸钠和亚硝酸钠,反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O,
故答案为:2NO2+2OH-=NO2-+NO3-+H2O.
点评 本题考查了物质转化关系,物质性质的分析判断,根据反应现象和物质性质及元素守恒进行物质推断是解题关键,题目难度中等.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案| A. | 向稀硝酸中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 氯气通入NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═AlO22-+4NH4++2H2O | |
| D. | 向水中加入Na2O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| A. | CH4 | B. | C2H4 | C. | C6H6 | D. | C3H6 |
| A. | 石油分馏和煤的液化均为物理变化 | |
| B. | 石油裂解的目的是为了提高汽油等轻质油的产量和质量 | |
| C. | 石油分馏实验中,温度计水银球插入石油中但不能碰到瓶壁 | |
| D. | 煤干馏得到的煤焦油中可以分离出苯、甲苯等有机物 |
Ⅰ.配制 0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,配制溶液需要用250ml容量瓶,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)a b e.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
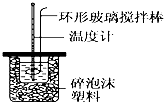
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中平均温度差的空格:
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 请填写(4.0℃ ) |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(保留小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填序号)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④已知强酸与强碱在稀溶液里反应的中和热可表示为
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1对下列反应:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-Q1 kJ•mol-1
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-Q2 kJ•mol-1
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-Q3 kJ•mol-1
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是A
A.Q2>Q3>Q1 B.Q2>Q1>Q3 C.Q1=Q2=Q3 D.Q2=Q3>Q1.
| A. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| B. | 只有在标准状况下,气体的摩尔体积才能约是22.4L•mol-1 | |
| C. | 一定温度和压强下,各种气态物质的体积大小由构成气体的分子大小决定 | |
| D. | 一定温度和压强下,各种气态物质的体积大小由构成气体的分子数决定 |
| A. | 煤、石油等化石燃料燃烧过程中排放的废气是形成酸雨的主要原因,酸雨指的是PH值小于7的雨水 | |
| B. | 煤和石油都属于一级能源而天然气属于二级能源 | |
| C. | 在煤中添加适量的石膏可减少燃烧过程中含硫化合物的排放从而减少污染 | |
| D. | 雾霾可能是许多细小液体和固体微粒分散到空气中形成的一种气溶胶 |
 已知A是单质,A、B、C、D、E 5种物质均含同一种元素,X是地壳中含量最多的元素形成的单质,它们的相互转化关系如图所示.试回答下列问题.
已知A是单质,A、B、C、D、E 5种物质均含同一种元素,X是地壳中含量最多的元素形成的单质,它们的相互转化关系如图所示.试回答下列问题.