题目内容
7.2015年4月7日,福建省漳州古雷PX化工厂发生爆炸,PX是“对二甲苯”英文名的缩写,“对二甲苯”属于( )| A. | 无机物 | B. | 有机物 | C. | 盐类 | D. | 单质 |
分析 A.无机物是指不含有碳元素的化合物.一氧化碳、二氧化碳、碳酸盐等物质中虽然含有碳元素,但是这些物质的性质和无机物相似,把它们归入无机物;
B.含有碳元素的化合物叫有机化合物,简称有机物.碳的氧化物、碳酸盐、碳酸虽含碳,但其性质与无机物类似,因此把它们看作无机物;
C.盐类是由金属离子(或铵根离子)和酸根离子组成的化合物;
D.单质是由同种元素组成的纯净物.
解答 解:对二甲苯是含有碳元素的化合物,属于有机物.
故选B.
点评 本题考查有机物的定义,难度不大,解答本题要掌握有机物和无机物的区别与联系,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目
18.向一密闭容器中充入1molN2和3molH2,在-定条件下发生反应N2+3H2?2NH3,下列有关说法正确的是( )
| A. | 当达到化学平衡时,N2的浓度保持不变 | |
| B. | 反应最终可生成2molNH3 | |
| C. | 当达到化学平衡时.正反应和逆反应的速率都为0 | |
| D. | 当反应达到化学平衡时,N2、H2、NH3的分子数比一定为1:3:2 |
15.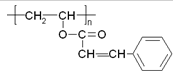 光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
 光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )| A. | 合成此高聚物的单体的化学式为C11H10O2 | |
| B. | 该物质可稳定存在于碱性溶液中 | |
| C. | 1mol该物质最多可与3molH2发生加成反应 | |
| D. | 该物质可经过缩聚反应制得 |
2.某有机物A的分子式为C4H8O2,下列有关分析正确的是( )
| A. | 若A有特殊香味且不溶于水,则A的结构有3种 | |
| B. | 若A与NaHCO3溶液反应有气体生成,则A的结构有4种 | |
| C. | 若A可发生银镜反应,则A的结构有5种 | |
| D. | 若A在稀硫酸催化下加热进行反应能生成两种有机物,则A的结构有4种 |
12.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 过氧化钠的电子式: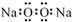 | |
| B. | “玉兔”号月球车上使用的质子数94,中子数144的钚原子:${\;}_{94}^{144}$Pu | |
| C. | CH4的球棍模型: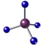 | |
| D. | Na的原子结构示意图: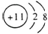 |
19.现有三组混合液:①汽油和水 ②乙醇和水 ③溴和水,分离以上各混合液的方法依次是( )
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
16.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应是:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如下:
①容器a达平衡时N2的平衡浓度c(N2)=3mol/L.
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol/L.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(1)下表列举了不同温度下大气固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2000 |
| K | 3.84×10-31 | 0.1 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应是:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的 能量变化 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 放热23.1kJ |
| b | 0.6 | 1.8 | 0.8 | 吸热Q kJ |
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol/L.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
17.下列关于化学反应限度的说法中正确的是( )
| A. | 当一个可逆反应达到平衡状态时,这个反应的正、逆反应速率相等 | |
| B. | 化学平衡状态是一种静止状态,因为反应物和生成物的浓度已经不再改变 | |
| C. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的最大限度 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |