题目内容
2.某有机物A的分子式为C4H8O2,下列有关分析正确的是( )| A. | 若A有特殊香味且不溶于水,则A的结构有3种 | |
| B. | 若A与NaHCO3溶液反应有气体生成,则A的结构有4种 | |
| C. | 若A可发生银镜反应,则A的结构有5种 | |
| D. | 若A在稀硫酸催化下加热进行反应能生成两种有机物,则A的结构有4种 |
分析 该分子中不饱和度=$\frac{4×2+2-8}{2}$=1,说明该分子中含有一个碳碳双键或碳氧双键,
A.若A有特殊香味且不溶于水,说明该物质中含有酯基,可能是甲酸丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯;
B.能和碳酸氢钠反应生成气体,说明含有羧基,可能是丁酸、2-甲基丙酸;
C.能发生银镜反应,则应为甲酸某酯或羟基醛;
D.若A在稀硫酸催化下加热进行反应能生成两种有机物,说明A是酯.
解答 解:该分子中不饱和度=$\frac{4×2+2-8}{2}$=1,说明该分子中含有一个碳碳双键或碳氧双键,
A.若A有特殊香味且不溶于水,说明该物质中含有酯基,可能是甲酸丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯,所以同分异构体有4种,故A错误;
B.能和碳酸氢钠反应生成气体,说明含有羧基,可能是丁酸、2-甲基丙酸,同分异构体有2种,故B错误;
C.分子式为C4H8O2能发生银镜反应,说明含有醛基,则可能为甲酸丙酯,甲酸有1种,丙醇有2种,甲酸丙酯共2种;
可能为羟基醛,丁醛有2种,羟基丁醛有5种:CH2OHCH2CH2CHO、CH3CH2OHCH2CHO、CH3CH2CH2OHCHO,CH2OHCHCH3CHO、(CH3)2CHCHO;
可能为醚醛,醚醛有3种:CH3CH2CH2OCHO、CH3CH2OCH2CHO、CH3OCH2CH2CHO;所以共有10种,故C错误;
D.若A在稀硫酸催化下加热进行反应能生成两种有机物,说明A是酯,根据A知,有4种同分异构体,故D正确;
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生发散思维能力,明确常见物质结构及其性质是解本题关键,易错选项是C.

练习册系列答案
相关题目
12.在下列制备环氧乙烷(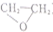 )的反应中,原子利用率最高的是( )
)的反应中,原子利用率最高的是( )
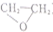 )的反应中,原子利用率最高的是( )
)的反应中,原子利用率最高的是( )| A. | CH2═CH2+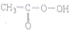 (过氧乙酸)→ (过氧乙酸)→ +CH3COOH +CH3COOH | |
| B. | CH2═CH2+Cl2+Ca(OH)2→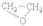 +CaCl2+H2O +CaCl2+H2O | |
| C. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$2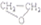 | |
| D. |  $\stackrel{催化剂}{→}$ $\stackrel{催化剂}{→}$ +HOCH2CH2-O-CH2CH2OH+2H2O +HOCH2CH2-O-CH2CH2OH+2H2O |
13.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | B. | 灼热的木炭与CO2反应 | ||
| C. | 镁条的燃烧 | D. | NaOH溶液与NH4Cl溶液的反应 |
17. 化合物I是一种不饱和脂类化合物,它在药物、涂料等应用广泛.下列关于化合物I的说法.正确的是( )
化合物I是一种不饱和脂类化合物,它在药物、涂料等应用广泛.下列关于化合物I的说法.正确的是( )
 化合物I是一种不饱和脂类化合物,它在药物、涂料等应用广泛.下列关于化合物I的说法.正确的是( )
化合物I是一种不饱和脂类化合物,它在药物、涂料等应用广泛.下列关于化合物I的说法.正确的是( )| A. | 化合物I的分子式为C17H17O3 | B. | 可发生酯化反应和银镜反应 | ||
| C. | 能与溴发生取代和加成反应 | D. | 反应遇FeCl3溶液可能显紫色 |
7.2015年4月7日,福建省漳州古雷PX化工厂发生爆炸,PX是“对二甲苯”英文名的缩写,“对二甲苯”属于( )
| A. | 无机物 | B. | 有机物 | C. | 盐类 | D. | 单质 |
14.在短周期元素中,原子最外层只有2个电子的元素是( )
| A. | 金属元素 | B. | 非金属元素 | C. | 稀有气体 | D. | 无法确定 |
11.铅蓄电池的电池反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$ 2PbSO4 (s)+2H2O(l).下列说法正确的是( )
| A. | 放电时,正极的反应式是:PbO2+SO42-+4H++2e-═PbSO4+2H2O | |
| B. | 放电时,电解质溶液中的H+向负极移动 | |
| C. | 充电时,阳极的电极反应为:PbSO4+2e-═Pb(s)+SO42- | |
| D. | 充电时,当有20.7gPb生成时,转移的电子为0.1mol |
12.锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.
请回答下列问题.
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm(1pm=10-10cm),列式计算晶体铜的密度9.0g/cm3.
(6)下表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
由此可得出的判断含氧酸强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.亚磷酸(H3PO3)也是中强酸,它的结构式为 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
请回答下列问题.
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm(1pm=10-10cm),列式计算晶体铜的密度9.0g/cm3.
(6)下表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O. 
 .
. ,90g乳酸与足量的金属钠完全反应生成的气体在标准状况下的体积为22.4LL.
,90g乳酸与足量的金属钠完全反应生成的气体在标准状况下的体积为22.4LL.