题目内容
17.有下列物质:①CO2②N2③H2O2④NH3⑤Ca(OH)2⑥Na2O2⑦NH4Cl,使用以上物质的序号填空:①既有极性键,又有非极性键的是③
②既有离子键,又有非极性键的是⑥
③属于18电子的分子的是③
④属于含有极性键的直线型分子的是①.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,根据各原子的质子数计算分子的电子数,根据分子的空间构型判断属于含有极性键的直线型分子.
解答 解:①CO2中C原子和O原子之间只存在极性键,是直线型分子,属于6+8×2=22电子的分子;
②N2分子中两个N原子之间只存在非极性键是直线型分子,属于7×2=14电子的分子;
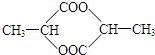
③H2O2分子中H原子和O原子之间存在极性键、O原子之间存在非极性键,是折线型分子,属于1×2+8×2=18电子的分子;
④NH3分子中N原子和H原子之间只存在极性键,是三角锥形分子,属于7+3×1=10电子的分子;
⑤Ca(OH)2 中钙离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,属于离子化合物;
⑥Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性键,属于离子化合物;
⑦NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性键,属于离子化合物;
①既有极性键,又有非极性键的是③,
故答案为:③;
②既有离子键,又有非极性键的是 ⑥,
故答案为:⑥;
③属于18电子的分子的是③,
故答案为:③;
④属于含有极性键的直线型分子的是①,
故答案为:①.
点评 本题考查了离子键和共价键、18电子微粒、分子构型的判断,根据物质的构成微粒及微粒间的作用力分析解答,题目难度不大.

练习册系列答案
相关题目
7. 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025mol/(L•min) | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡移动 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75% |
8.下列离子方程式书写正确的是( )
| A. | 碳酸钙跟稀盐酸反应CO32-+2H+=CO2↑+H2O | |
| B. | 向碳酸钠溶液中加入过量醋酸溶液CO32-+2H+=CO2↑+H2O | |
| C. | 氯气与水反应Cl2+H2O=2H++Cl-+ClO- | |
| D. | 三氯化铝溶液与氨水Al3++3NH3•H2O=Al(OH)3↓+3NH4 + |
12.在下列制备环氧乙烷(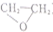 )的反应中,原子利用率最高的是( )
)的反应中,原子利用率最高的是( )
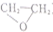 )的反应中,原子利用率最高的是( )
)的反应中,原子利用率最高的是( )| A. | CH2═CH2+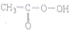 (过氧乙酸)→ (过氧乙酸)→ +CH3COOH +CH3COOH | |
| B. | CH2═CH2+Cl2+Ca(OH)2→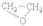 +CaCl2+H2O +CaCl2+H2O | |
| C. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$2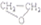 | |
| D. |  $\stackrel{催化剂}{→}$ $\stackrel{催化剂}{→}$ +HOCH2CH2-O-CH2CH2OH+2H2O +HOCH2CH2-O-CH2CH2OH+2H2O |
2.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 已知H2C2O4为二元弱酸,则Na2C2O4溶液:c(OH- )=c(H+ )+c(H2C2O4-)+c(H2C2O4) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X-)>c(OH-)=c(H+) | |
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:2c(S2-)+c(OH-)+c(HS-)=c(H+)+c(Na+) |
9.下列关于化学反应的速率和限度的说法错误的是( )
| A. | 化学反应速率通过用单位时间里反应物浓度或生成物浓度的变化量表示 | |
| B. | 影响化学反应速率的条件只有温度和催化剂 | |
| C. | 化学平衡状态指的是在一定条件下反应物和生成物浓度不再改变时的状态 | |
| D. | 催化剂只能加快化学反应速率,不能提高原料利用率和转化率 |
6.下列实验设计合理或能够达到实验目的是( )
| A. |  分离碘酒中的碘和酒精 | B. |  除去Cl2中HCl | ||
| C. |  吸收SO2气体 | D. |  收集NH3并吸收多余NH3 |
7.2015年4月7日,福建省漳州古雷PX化工厂发生爆炸,PX是“对二甲苯”英文名的缩写,“对二甲苯”属于( )
| A. | 无机物 | B. | 有机物 | C. | 盐类 | D. | 单质 |
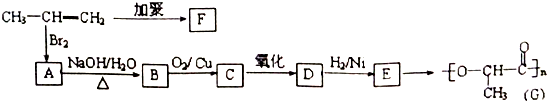
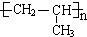 .
.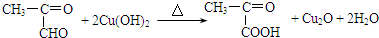 .
. .
.