题目内容
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
【答案】 100mL容量瓶 B 淀粉溶液 滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色 17.92% bc
【解析】(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和100mL容量瓶。(2)Na2S2O3溶液显碱性,则Na2S2O3标准液应装在碱式滴定管中,即答案选B。(3)碘遇淀粉显蓝色,则指示剂应选用淀粉溶液,反应中单质碘被消耗,则判断达到滴定终点的现象是滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色。(4)根据表中数据可知三次滴定消耗标准液体积分别是19.90mL、20.00mL、20.10mL,所以消耗标准液体积的平均值是20.00mL。根据方程式5CO+I2O5![]() 5CO2+I2、2Na2S2O3+I2=2NaI+Na2S4O6可知5CO~I2~2Na2S2O3,则气体样品中CO的体积分数为
5CO2+I2、2Na2S2O3+I2=2NaI+Na2S4O6可知5CO~I2~2Na2S2O3,则气体样品中CO的体积分数为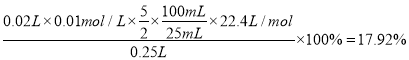 ;(5)a.滴定终点俯视读数,读数偏小,结果偏低,a错误;b.锥形瓶用待测溶液润洗,消耗标准液体积增加,结果偏高,b正确;c.滴定前有气泡,滴定后没有气泡,消耗标准液体积增加,结果偏高,c正确;d.配制100 mL待测溶液时,有少量溅出,浓度偏低,消耗标准液体积减少,结果偏低,d错误,答案选bc。
;(5)a.滴定终点俯视读数,读数偏小,结果偏低,a错误;b.锥形瓶用待测溶液润洗,消耗标准液体积增加,结果偏高,b正确;c.滴定前有气泡,滴定后没有气泡,消耗标准液体积增加,结果偏高,c正确;d.配制100 mL待测溶液时,有少量溅出,浓度偏低,消耗标准液体积减少,结果偏低,d错误,答案选bc。